
用28 g鐵粉和28 g鎂粉分別與足量的稀硫酸反應都生成l g氫氣,由此可以得出的結論是相對原子質量:Fe-56,H-1,Mg-24
A.鐵粉、鎂粉都含有雜質 B.鐵粉、鎂粉都是純凈物
C.鐵粉是純凈物,鎂粉含雜質 D.鐵粉含雜質,鎂粉是純凈物
 寒假大串聯黃山書社系列答案
寒假大串聯黃山書社系列答案 寒假創新型自主學習第三學期寒假銜接系列答案
寒假創新型自主學習第三學期寒假銜接系列答案科目:初中化學 來源: 題型:
 (2013?荊門)某化學興趣小組使用右圖所示裝置,對某種鐵銅合金的成分進行測量.先取足量稀硫酸于燒杯中,再向其中加入14.0g合金樣品開始計時,并將電子天平的讀數記錄在下表中,請回答下列問題:
(2013?荊門)某化學興趣小組使用右圖所示裝置,對某種鐵銅合金的成分進行測量.先取足量稀硫酸于燒杯中,再向其中加入14.0g合金樣品開始計時,并將電子天平的讀數記錄在下表中,請回答下列問題:| 空燒杯 | 加入 硫酸后 |
加入鐵粉后 5分鐘 |
加入鐵粉后 12分鐘 |
加入鐵粉后 21分鐘 |
加入鐵粉后 40分鐘 |
加入鐵粉后 3小時 | |
| 讀數(g) | 28.5 | 169.7 | 183.6 | 183.5 | 183.4 | 183.3 | 183.3 |
查看答案和解析>>
科目:初中化學 來源:2008年江蘇省揚州市初中畢業升學統一考試、化學試卷 題型:058
無焰食品加熱器常用于野外加熱食物,它的成分是鎂粉、鐵粉、氯化鈉.使用時加入水,鎂與水反應產生熱量.下面是在18℃、標準大氣壓的環境中對該產品的實驗研究,請結合以下實驗方案回答有關問題(不考慮氯化鈉對水沸點的影響).
實驗1:
Ⅰ、將一定質量的鎂條、鐵粉和氯化鈉加入盛有100 mL水的隔熱容器中,連續攪拌,每50 s記錄一次溫度,得圖1中曲線a;
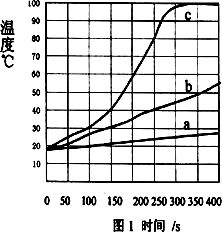
Ⅱ、將相同質量的鎂條剪成100份代替Ⅰ中鎂條重復以上實驗,得圖1中曲線b;
Ⅲ、用相同質量的鎂粉代替Ⅰ中鎂條重復以上實驗,得圖1中曲線c.
(1)從能量變化角度看,該變化是________能轉化為________能.
(2)觀察圖1,從中可以發現影響鎂和水反應速率的因素是________.
實驗2:將2.40 g鎂粉和質量為28.00 g的鐵粉混合,加入盛有100 mL水的隔熱容器中,不斷攪拌.氯化鈉用量不同時,溫度變化情況如圖2所示.
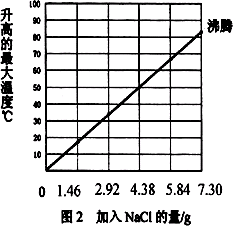
(3)實驗2中,當NaCl質量大于7.30 g時,實驗不再做的原因是________.
A.加入更多的NaCl不再增加反應速率
B.加入更多的NaCl會降低反應速率
C.已達到水的沸點,溫度不會再有變化
D.需加入更多的鐵粉來提高水的溫度
(4)如果在實驗2中加入質量為3.65 g NaCl,混合物的溫度最高大約是________.
(5)某同學設計了下面四種無焰食品加熱器物料配方,請根據本次實驗研究的結論,判斷其中最合理的是________.
A.2.40 g鎂粉、7.30 g NaCl和28.00 g鐵粉
B.2.40 g鎂條、7.30 g NaCl和28.00 g鐵粉
C.2.40 g鎂粉、8.76 g NaCl和28.00 g鐵粉
D.2.40 g鎂條、8.76 g NaCl和28.00 g鐵粉
理由是_________________.
查看答案和解析>>
科目:初中化學 來源: 題型:
 某化學興趣小組使用右圖所示裝置,對某種鐵銅合金的成分進行測量。先取足量稀硫酸于燒杯中,再向其中加入14.0g合金樣品開始計時,并將電子天平的讀數記錄在下表中,請回答下列問題:
某化學興趣小組使用右圖所示裝置,對某種鐵銅合金的成分進行測量。先取足量稀硫酸于燒杯中,再向其中加入14.0g合金樣品開始計時,并將電子天平的讀數記錄在下表中,請回答下列問題:
⑴根據電子天平讀數和時間的關系分析,該反應進行過程中,氫氣
的產生速度有什么特點?
⑵完全反應后,燒杯中鹽的質量分數為多少?(用百分數表示)
⑶合金中鐵元素的質量百分含量為多少?
| 空燒杯 | 加入 硫酸后 | 加入鐵粉后 5分鐘 | 加入鐵粉 12分鐘 | 加入鐵粉后 21分鐘 | 加入鐵粉后 40分鐘 | 加入鐵粉后 3小時 | |
| 讀數(g) | 28.5 |
| 183.6 | 183.5 | 183.4 | 183.3 | 183.3 |
查看答案和解析>>
科目:初中化學 來源: 題型:
用28 g鐵粉和28 g鎂粉分別與足量的稀硫酸反應都生成l g氫氣,由此可以得出的結論是( )
A.鐵粉、鎂粉都含有雜質 B.鐵粉、鎂粉都是純凈物
C.鐵粉是純凈物,鎂粉含雜質 D.鐵粉含雜質,鎂粉是純凈物
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com