
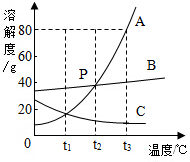
 如圖是A、B、C三種固體物質的溶解度曲線,回答下列問題
如圖是A、B、C三種固體物質的溶解度曲線,回答下列問題分析 (1)根據溶解度曲線交點的含義進行分析;
(2)據物質的溶解度曲線可比較同一溫度下不同物質的溶解度大小;
(3)根據物質的溶解度曲線可以判斷一定溫度時,一定量的溶劑中能夠溶解的溶質質量;
(4)從溶液中結晶的方法有兩種:蒸發結晶和降溫結晶,物質的溶解度受溫度變化影響較小時,應該用蒸發結晶;物質的溶解度受溫度變化影響較大時,應該用降溫結晶;
(5)根據t2℃、t1℃時三種物質的溶解度大小關系,三種物質溶解度受溫度的影響的變化趨勢判斷降溫后溶液是否析出晶體、是否飽和,進而確定所得溶液中溶質的質量分數的大小.
解答 解:(1)P點是t2℃時,A、B的溶解度曲線的交點,表示該溫度下兩物質的溶解度相等;
(2)t1℃時A、B、C三種物質的溶解度由大到小的順序B>A=C;
(3)t3℃時A的溶解度是80g,即100g水中最多溶解80g的A,所以將40克A加到50克水中,充分攪拌后恰好溶解,得到溶液的質量為90g;
(4)A物質的溶解度受溫度變化影響較大,因此要從A的熱溶液中獲得晶體,應采用最適宜的方法是冷卻熱飽和溶液或降溫結晶;
(5)t2℃時,將A、B、C的飽和溶液(都含有100g水),降溫到t1℃時A的溶解度變化最大,析出晶體最多,C溶解度減小,無晶體析出;
飽和時質量分數的計算式$\frac{溶解度}{溶解度+100g}$×100%,即溶解度大則溶質的質量分數大,由于在t2℃時,三種物質的溶解度大小關系是A=B>C,即在t2℃時,三種物質的飽和溶液中溶質的質量分數:A=B>C;由于A和B的溶解度隨溫度的降低而減小,因此降溫至t1℃時,A和B的溶液中都會有晶體析出,溶液都還是飽和溶液,由于在t1℃時三種物質的溶解度B>A=C,而由于C的溶解度隨溫度的降低而增大,因此降溫至t1℃時,它的飽和溶液就會變成不飽和溶液,但由于溶液的組成沒有發生改變,故C溶液中溶質的質量分數不變,與降溫前相等,其溶解度小于t1℃,由圖可知,C的溶液中溶質的質量分數還是最小;故所得溶液的溶質質量分數由小到大依次為CAB;
故答案為:(1)t2℃時,A、B的溶解度相等;
(2)B>A=C;
(3)90;
(4)冷卻熱飽和溶液(或降溫結晶);
(5)A;C;CAB.
點評 本題難度不是很大,主要考查了對固體溶解度的概念的理解和固體溶解度曲線的意義,以此培養學生的理解能力、培養學生分析問題、解決問題的能力.


科目:初中化學 來源: 題型:解答題
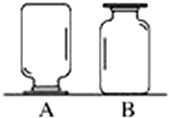 如圖,在實驗臺上放置兩瓶氣體,集氣瓶A、B中盛有二氧化碳(密度比空氣的大)、氧氣(密度比空氣的大)、氫氣(密度比空氣的小)中的一種.小剛和小強想對瓶中氣體進行探究:
如圖,在實驗臺上放置兩瓶氣體,集氣瓶A、B中盛有二氧化碳(密度比空氣的大)、氧氣(密度比空氣的大)、氫氣(密度比空氣的小)中的一種.小剛和小強想對瓶中氣體進行探究:查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
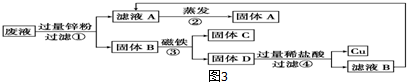
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| 選 項 | 物質 | 雜質(少量) | 試劑及操作方法 |
| A | 氧化鈣 | 石灰石 | 高溫 |
| B | 稀鹽酸 | 稀硝酸 | 加入過量的硝酸銀溶液,過濾 |
| C | 氯化鈉 | 泥沙 | 加入足量的水,溶解、蒸發、結晶 |
| D | 氯化鎂溶液 | 稀鹽酸 | 加入過量的氫氧化鎂,過濾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com