
化學實驗課上老師要求分組除去鐵制品和銹銅幣表面的銹層并對廢液進行處理。請你參與并回答相關問題。

(1)實驗一:表面除銹
甲組:將銹鐵器放入適量稀硫酸中,微熱。觀察到①溶液變成黃色,鐵銹逐漸消失。一段時間后,②銹層完全消失,鐵器表面有細小氣泡產生,③黃色溶液逐漸變為淺綠色。
a) 現象①發生的化學反應方程式為:______ _____,
b) ②中鐵器表面的氣泡是什么氣體__ _;
c) 大家對現象③不理解,老師提示大家:金屬單質鐵和銅都可以將+3價的鐵元素轉變為+2價鐵元素,其中銅發生的反應過程為2FeCl3+Cu → 2FeCl2 + CuCl2 。
請你根據老師的提示推測產生現象③的原因 。(只寫出有關反應的化學方程式)
乙組:(1)在銹銅錢中加入適量稀硫酸。觀察到①綠色銹層很快消失,同時產生大量氣泡,溶液變成藍色 。②將氣體收集,通入澄清石灰水,石灰水變渾濁。由此,小軍等同學推斷,綠色銅銹層中肯定含有的元素有___ ______。
(2)實驗二:廢液回收
廢液桶中收集了溶有大量FeSO4、CuSO4的廢水,若直接排放到下水道,不僅造成重金屬污染而且浪費資源。小組討論后設計了如下回收硫酸亞鐵晶體和銅的實驗方案:

請完成下列有關問題:
① 金屬X是 ,其加入廢水后發生反應的化學方程式為 ;
利用溶液Y除去銅中雜質,有關反應的化學方程式為 。
甲組 Fe203 + 3H2SO4 == Fe2(SO4)3+3H2O ,H2 , Fe2(SO4)3 + Fe == 3FeSO4
乙組:(1)碳元素,銅元素
(2)Fe , Fe +CuSO4 ==FeSO4 +Cu, Fe+ H2SO4==H2↑+FeSO4
【解析】實驗一:1)根據實驗現象可以知道:溶液變成黃色,鐵銹逐漸消失可以判斷發生的反應為氧化鐵和稀硫酸的反應,它們反應的化學方程式分別為:
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
2)一段時間后銹層完全消失,鐵器表面有細小氣泡產生,說明此時過量的硫酸和鐵發生反應生成了氫氣;
3)根據信息,金屬單質鐵可以將+3價的鐵元素轉變為+2價鐵元素,所以溶液由黃色逐漸變為淺綠色,故方程式為:Fe+Fe2(SO4)3=3FeSO4;
而將銅銹加入稀硫酸中看到①綠色銹層很快消失,溶液變成藍色,說明是硫酸銅的溶液;②產生了使澄清石灰水變渾濁的氣體,可以判斷該氣體為二氧化碳,所以根據質量守恒定律可以判斷銅銹中含有的元素為:Cu、C、O三種元素;
實驗二:(1)從圖框中可以知道,向廢液中加入過量的金屬X得到了不純的銅,根據題干要求及廢水中的成分并結合最后得到對物質為硫酸亞鐵晶體,可以判斷金屬X為鐵;(2)加入溶液Y后將過量的鐵和銅分離得到了銅,可以判斷加入的Y為稀硫酸。


 學練快車道快樂假期寒假作業系列答案
學練快車道快樂假期寒假作業系列答案科目:初中化學 來源: 題型:閱讀理解
 (2012?濰坊二模)化學實驗課上老師要求分組除去鐵制品和銹銅幣表面的銹層并對廢液進行處理.請你參與并回答相關問題.
(2012?濰坊二模)化學實驗課上老師要求分組除去鐵制品和銹銅幣表面的銹層并對廢液進行處理.請你參與并回答相關問題.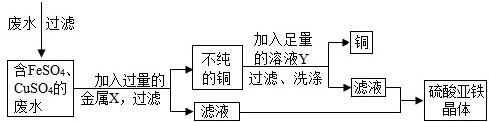
查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
 (2012?密云縣二模)化學實驗課上老師要求分組除去鐵制品和銹銅幣表面
(2012?密云縣二模)化學實驗課上老師要求分組除去鐵制品和銹銅幣表面
查看答案和解析>>
科目:初中化學 來源:2012屆山東省濰坊市初中學業水平考試二模化學試卷(帶解析) 題型:探究題
化學實驗課上老師要求分組除去鐵制品和銹銅幣表面的銹層并對廢液進行處理。請你參與并回答相關問題。
實驗一:表面除銹
甲組:將銹鐵器放入適量稀硫酸中,微熱。觀察到①溶液變成黃色,鐵銹逐漸消失;②一段時間后,銹層完全消失,鐵器表面有細小氣泡產生;③黃色溶液逐漸變為淺綠色。
現象①發生的化學反應方程式為:____________________________________,②中鐵器表面的氣泡是________;大家對現象③不理解,老師補充說明了,金屬鐵具有還原性,能將正三價的鐵離子還原成亞鐵離子。
乙組:在銹銅錢中加入適量稀硫酸。觀察到①綠色銹層很快消失,同時產生大量氣泡,溶液變成藍色;②將氣體收集,通入澄清石灰水,石灰水變渾濁。由此,小軍等同學推斷,綠色銹層中肯定含有的元素有_________________。
實驗二:廢液回收
廢液桶中收集了溶有大量FeSO4、CuSO4的廢水,若直接排放到下水道,不僅造成重金屬污染而且浪費資源。小組討論后設計了如下除去銅離子,回收硫酸亞鐵晶體和銅的實驗方案:
請完成下列有關問題:
(1)廢水在加入金屬X前需進行過濾,目的是將其中 性雜質除去。
(2)金屬X是 ,其加入廢水后發生反應的化學方程式為 ;
溶液Y是 ,利用其除去銅中雜質,有關反應的化學方程式為 。
(3)從濾液中獲取硫酸亞鐵晶體的操作方法是 。
查看答案和解析>>
科目:初中化學 來源:2012年江蘇省南京市雨花臺區中考化學一模試卷(解析版) 題型:解答題


查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com