【答案】
分析:(1)CO具有還原性,能與氧化鐵反應而使氧化鐵還原成鐵,同時放出二氧化碳;
(2)焦炭燃燒放出大量的熱,該熱量可維持其它反應的發生;
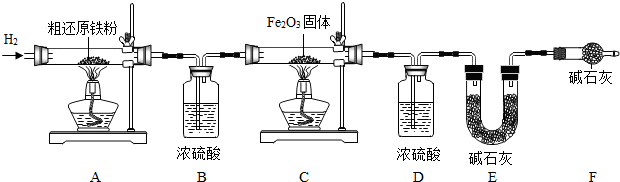
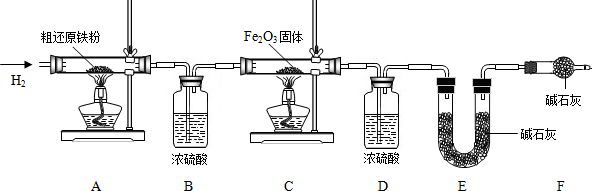
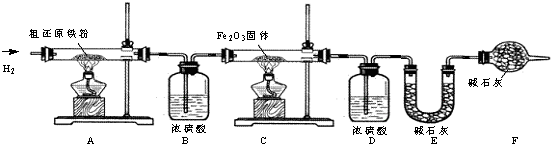
(3)裝置A在加熱時發生反應,生成的水與甲烷通過裝置B處理后進入裝置C,進入該裝置的氣體在加熱條件下發生反應;
(4)步驟③的目的是 除去裝置內的氧氣,防止發生爆炸,驗證該步驟目的達到的實驗方法是收集尾氣靠近燃著的酒精燈,聽聲音;步驟⑥的目的是 防止生成的還原鐵粉再次被氧化,起保護作用
(5)若裝置D、E分別增重mg和ng,當只有甲烷參與反應時可以求出二氧化碳和水的質量比為9:11,可求m與n的關系
若缺少裝置D,氧元素的測定時取決于B裝置的吸收,所以是不會影響的(后面與氧化鐵的反應物是甲烷氣體反應造成的,所以二氧化碳中的氧元素不會影響到).碳元素的質量分數是通過吸收二氧化碳,也可以說通過E裝置的質量增加來實現,當D不存在時,導致部分水被E吸收,而被誤當成二氧化碳進行計算,導致碳元素質量增加,進而使含碳量偏大.
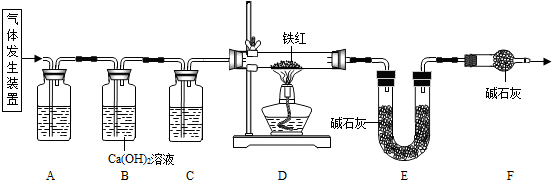
(6)裝置B中濃硫酸吸收氫氣與粗還原鐵粉反應生成的水,由該裝置增重為反應生成水的質量可求得粗還原鐵粉中氧元素質量;裝置E中堿石灰吸收甲烷與氧化鐵反應產生的二氧化碳,由該裝置增重為反應生成二氧化碳的質量可計算出粗還原鐵粉中所含碳元素質量.
解答:解:(1)氧化鐵在高溫條件下能與CO發生反應生成鐵與二氧化碳,反應的化學方程式為Fe
2O
3+3CO
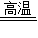
2Fe+3CO
2;
(2)焦炭燃燒放出大量的熱,產生的熱量使裝置內其它反應得以發生;
(3)根據題目中的假設情況,為使裝置A反應產生的甲烷氣體全部在裝置C中發生反應,操作時應先將C處酒精燈點燃,然后再點燃A處酒精處;
(4)步驟③的目的是 除去裝置內的氧氣,防止發生爆炸,驗證該步驟目的達到的實驗方法是收集尾氣靠近燃著的酒精燈,聽聲音;有剩余則沒有完全被除掉;步驟⑥的目的是 防止生成的還原鐵粉再次被氧化,起保護作用
(5)若裝置D、E分別增重mg和ng,當只有甲烷參與反應時可以求出二氧化碳和水的質量比為9:11,可求m與n的關系.
3CH
4+4Fe
2O
3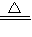
8Fe+3CO
2+6H
2O
3×44 6×18
n m
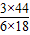
=
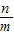
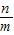
=
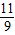
由于是加熱C在前,所以導致會先生成水,導致水的質量多,所以是9n<11m,所以選C.
若缺少裝置D,氧元素的測定時取決于B裝置的吸收,所以是不會影響的(后面與氧化鐵的反應物是甲烷氣體反應造成的,所以二氧化碳中的氧元素不會影響到).碳元素的質量分數是通過吸收二氧化碳,也可以說通過E裝置的質量增加來實現,當D不存在時,導致部分水被E吸收,而被誤當成二氧化碳進行計算,導致碳元素質量增加,進而使含碳量偏大.
(6)裝置B增重0.180g,則粗還原鐵粉與氫氣反應生成水的質量為0.180g,生成水中氧元素質量=0.180g×
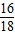
×100%=0.160g;
樣品中氧元素的質量分數=
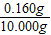
×100%=1.6%
裝置E增重0.220g,則甲烷與氧化鐵反應生成二氧化碳的質量為0.220g,生成二氧化碳中碳元素質量=0.220g×
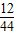
×100%=0.060g;
樣品中碳元素的質量分數=
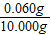
×100%=0.6%
答:樣品中氧和碳元素的質量分數分別為1.6%、0.6%.
故答案為:
(1)Fe
2O
3+3CO
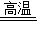
2Fe+3CO
2;
(2)提供熱量;
(3)④②;
(4)除去裝置內的氧氣,防止發生爆炸; 收集尾氣靠近燃著的酒精燈,聽聲音;防止生成的還原鐵粉再次被氧化,起保護作用
(5)C;等于;偏大;
(6)裝置B增重0.180g,則粗還原鐵粉與氫氣反應生成水的質量為0.180g,生成水中氧元素質量=0.180g×
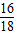
×100%=0.160g;
樣品中氧元素的質量分數=
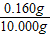
×100%=1.6%
裝置E增重0.220g,則甲烷與氧化鐵反應生成二氧化碳的質量為0.220g,生成二氧化碳中碳元素質量=0.220g×
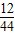
×100%=0.060g;
樣品中碳元素的質量分數=
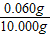
×100%=0.6%
答:樣品中氧和碳元素的質量分數分別為1.6%、0.6%.
點評:通過對鐵冶煉原理的知識遷移,理解該題的實驗過程及目的,考查了知識的運用及實驗分析的能力.


 xFe+yH2O Fe3C+2H2
xFe+yH2O Fe3C+2H2 3Fe+CH4
3Fe+CH4 3CO2+6H2O+8Fe
3CO2+6H2O+8Fe
 2Fe+3CO2;
2Fe+3CO2; 8Fe+3CO2+6H2O
8Fe+3CO2+6H2O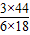 =
=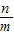
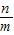 =
=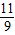
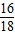 ×100%=0.160g;
×100%=0.160g;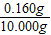 ×100%=1.6%
×100%=1.6%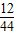 ×100%=0.060g;
×100%=0.060g;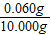 ×100%=0.6%
×100%=0.6% 2Fe+3CO2;
2Fe+3CO2;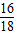 ×100%=0.160g;
×100%=0.160g;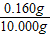 ×100%=1.6%
×100%=1.6%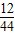 ×100%=0.060g;
×100%=0.060g;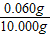 ×100%=0.6%
×100%=0.6%




 xFe+yH2O Fe3C+2H2
xFe+yH2O Fe3C+2H2 3Fe+CH4
3Fe+CH4 3CO2+6H2O+8Fe
3CO2+6H2O+8Fe