
(7分)某同學做了如下實驗: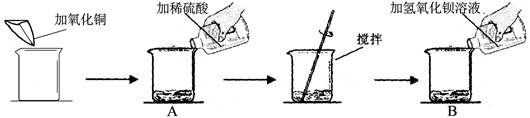
實驗數據及部分實驗現象如下表:
| | 第一次[來源:學.科.網Z.X.X.K] | 第二次 |
| 加氧化銅的質量(g) | m | m |
| 加稀硫酸的質量(g) | 50 | 100 |
| 加氫氧化鋇溶液的質量(g) | 100 | 100 |
| B中主要現象 | 淡藍色沉淀 | ? |
(1) CuO + H2SO4 = CuSO4 + H2O Ba(OH)2 +CuSO4 =Cu(OH)2↓ + BaSO4↓
(2)產生白色沉淀(藍色溶液變淺) (3) 4
(4) 171/233=8.55g/X (5)5% (6)135g
解析試題分析:(1)第一次試驗是在氧化銅中加入稀硫酸,發生反應生成硫酸銅藍色溶液,化學反應方程式為 :CuO + H2SO4 = CuSO4 + H2O,生成的硫酸銅溶液繼續與氫氧化鋇溶液反應,化學反應方程式為 :Ba(OH)2 +CuSO4 =Cu(OH)2↓ + BaSO4↓
(2)由于第一次試驗每一步均恰好完全反應,所以第二次實驗加入 100g稀硫酸,說明過量,所以第二次實驗B中的主要現象是產生白色沉淀(藍色溶液變淺)
(3)根據化學反應:CuO + H2SO4 = CuSO4 + H2O和Ba(OH)2 +CuSO4 =Cu(OH)2↓ + BaSO4↓,可以看出CuO與Ba(OH)2的質量關系80:171,而氫氧化鋇的質量=100g×8.55%=8.55g,所以不難算出CuO的質量m=4g
(4)第二次反應發生的方程式為:Ba(OH)2+H2SO4==BaSO4↓+2H2O根據Ba(OH)2與BaSO4的質量關系為171:233,而Ba(OH)2的質量為100g×8.55%=8.55g,所以可設BaSO4的質量為x,故可列式為:171/233=8.55g/X
(5)第二次反應后的濾液是加入了100g稀硫酸反應得到的溶液 ,根據第一次反應的質量關系,CuO + H2SO4 = CuSO4 + H2O,可計算出溶質CuSO4的質量為 8g,而根據方程式:Ba(OH)2+H2SO4==BaSO4↓+2H2O,可算出BaSO4的質量=11.65g,故溶液質量=4g+100g+100g-11.65g=192.35g,,所以將第二次反應后的濾液蒸發32.35克水,此時溶液的質量變為=192.35-32.35g=160g,則所得不飽和溶液中溶質的質量分數=8g/160g×100%=5%
(6)根據反應CuO + H2SO4 = CuSO4 + H2O中CuO與H2SO4的質量關系為80:98,CuO的質量m=4g,所以H2SO4的質量=4.9g,所以H2SO4的質量分數=4.9g/50g×100%=9.8%,所消耗的稀硫酸總質量為150g,所以根據稀釋前后的溶質質量不變,可設98%的濃硫酸質量為 x,可列式為 :98%×x=150g×9.8%,所以x=15g,故水的質量=150g-15g=135g
考點:化學反應方程式的書寫,根據化學反應方程式計算,溶液的稀釋


 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案 綜合自測系列答案
綜合自測系列答案科目:初中化學 來源: 題型:單選題
實驗室存有一定量的溶質質量分數為5%的氫氧化鈉溶液,加熱蒸發掉108g水后,所得溶液的溶質質量分數變為20%。
求:(1)原氫氧化鈉溶液的質量是多少克?
(2)原氫氧化鈉溶液中含有溶質多少克?
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(11分)煤、石油和天然氣等化石燃料是目前人類使用的最主要燃料,也是重要的化工原料。
(1)石油中主要含有 兩種元素(填寫元素符號);天然氣的主要成分是 (填寫化學式)。
(2)化石燃料屬于 (選填“可再生”或“不可再生”)能源,其燃燒排放的大量二氧化碳會引起全球氣候變暖。一種新的處理方法是將二氧化碳氣體通入含有長石(地殼中最常見的礦石,含量高達60%)成分的水溶液里,其中一種反應的化學方程式: KAlSi3O8+CO2+2H2O==KHCO3+X+3SiO2↓,則X的化學式為 。
(3)工業上,煤炭燃燒前進行粉碎的目的是 。煤隔絕空氣加強熱得到的焦炭,是冶鐵的重要原料。為了測定某赤鐵礦中氧化鐵的質量分數,化學興趣小組的同學設計了兩種實驗方案(假設該赤鐵礦中的雜質既不溶于水,也不發生反應)。
方案I 取8.00g赤鐵礦粉,加入足量稀硫酸,完全反應后過濾,得到1.60g濾渣。則赤鐵礦粉中氧化鐵的質量分數為 。
方案Ⅱ 如圖所示,取8.00g赤鐵礦粉與過量的焦炭粉混合后加強熱,充分反應。測得氫氧化鈉溶液反應前后質量增加了1.32g。如果產生的二氧化碳被氫氧化鈉溶液完全吸收,根據所學反應3C+2Fe2O3△4Fe+3CO2↑計算,赤鐵礦粉中氧化鐵的質量分數為 。
[實驗反思]方案Ⅱ中硬質玻璃管內原有的空氣對實驗結果有影響,這會導致測出的氧化鐵的質量分數 (選填“偏大”、“偏小”或“不變”)。
[實驗分析]方案I測出的氧化鐵的質量分數明顯大于方案Ⅱ測出的結果,可能的原因是 (寫出一種即可)。
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
某品牌純堿中含有雜質NaCl,化學興趣小組的同學進行了如下實驗探究:稱取12g樣品放入燒杯中,加入稀鹽酸至不再產生氣泡為止,并繪制出加入稀鹽酸的質量與放出氣體質量的關系如圖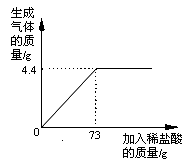
(1)純堿恰好完全反應時,生成CO2的質量為 g
(2)計算該樣品中含雜質的質量分數是多少?(計算結果保留一位小數,下同)
(3)計算當鹽酸與純堿恰好完全反應時,所得溶液的溶質質量分數是多少?
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(12分)某氫氧化鈣中含有碳酸鈣雜質,稱取研細的該樣品12.4g放入錐形瓶中,加入32.6g水,充分振蕩形成懸濁液,再向錐形瓶中逐滴滴加鹽酸使其充分反應至無氣泡產生,測得加入鹽酸的質量與錐形瓶中物質的質量關系如下表所示.
| 加入鹽酸的質量/g | 0 | 25 | 37.5 |
| 錐形瓶中物質的質量/g | 45 | 70 | 80.3 |
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(6分)稱取NaCl和BaCl2的固體混合物32.5g,加入100g蒸餾水,完全溶解后向該混合溶液中逐滴加入質量分數為10%的Na2SO4溶液,反應生成BaSO4沉淀的質量與所加入的Na2SO4溶液的質量關系如圖所示.試回答下列問題: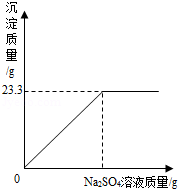
(1)完全反應后生成BaSO4沉淀 g.
(2)恰好完全反應時消耗Na2SO4溶液的質量是多少克?
(3)恰好完全反應時所得溶液中溶質的質量分數是多少?
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(7分)在一燒杯中盛有60.2gBaCO3和BaCl2的粉末狀混合物,向其中加入188.8g水使混合物中可溶物完全溶解,然后向其中逐滴加入溶質質量分數為10%的稀鹽酸至146g時恰好反應完全,請根據題意回答問題:
(1)在滴加鹽酸過程中觀察到的明顯實驗現象是 。
(2)當鹽酸滴加至140g時,燒杯中溶液里含有溶質的是 。(寫化學式)
(3)計算恰好反應完全時燒杯中所得不飽和溶液的質量。(結果精確到0.1g)
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(3分)硫代硫酸鈉(Na2S2O3)是一種用途廣泛的物質。某硫代硫酸鈉樣品中含有少量的硫酸鈉。現取16 g該樣品放入燒杯中,加入113.6 g一定溶質質量分數的稀硫酸恰好完全反應,得到120 g硫酸鈉不飽和溶液。
發生反應的化學方程式為:Na2S2O3 + H2SO4=== Na2SO4 + H2O + S↓+ SO2↑
請計算:
(1)樣品中硫代硫酸鈉(Na2S2O3)與硫酸鈉的質量比。
(2)所得溶液中溶質質量分數。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com