
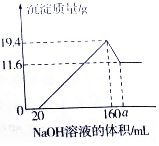
 已知:Mg(OH)2是難溶性堿,不溶于堿性溶液;A1(OH)3也是難溶性堿,但它既可以與強酸反應,生成可溶性鋁鹽,也可以與強堿反應,生成可溶性偏鋁酸鹽,例如Al(OH)3+NaOH=NaAlO2(偏鋁酸鈉)+2H2O.現將一定質量的鎂鋁合金樣品全部溶于100mL某濃度的鹽酸溶液中,之后向所得溶液中滴加200g/L的NaOH溶液,生成沉淀質量與加入的NaOH溶液體積關系如圖所示.
已知:Mg(OH)2是難溶性堿,不溶于堿性溶液;A1(OH)3也是難溶性堿,但它既可以與強酸反應,生成可溶性鋁鹽,也可以與強堿反應,生成可溶性偏鋁酸鹽,例如Al(OH)3+NaOH=NaAlO2(偏鋁酸鈉)+2H2O.現將一定質量的鎂鋁合金樣品全部溶于100mL某濃度的鹽酸溶液中,之后向所得溶液中滴加200g/L的NaOH溶液,生成沉淀質量與加入的NaOH溶液體積關系如圖所示.分析 由于在混合溶液中有鎂離子和鋁離子,所以加入氫氧化鈉溶液至160mL時沉淀質量最大,此時是生成的氫氧化鎂和氫氧化鋁.由繼續加入氫氧化鈉溶液只有氫氧化鋁反應,所以根據減少的固體的質量為氫氧化鋁可以求算消耗的氫氧化鈉溶液的體積.由于氯元素和鈉元素守恒,可得100mL稀鹽酸中的HCl的氯元素和氫氧化鈉中的鈉元素都進入了氯化鈉,得關系式為HCl~~~NaCl~~~NaOH,求算100mL鹽酸中的HCl的質量.
解答 解:
由于在混合溶液中有鎂離子和鋁離子,所以加入氫氧化鈉溶液至160mL時沉淀質量最大,此時是生成的氫氧化鎂和氫氧化鋁,對應的化學式是Mg(OH)2和Al(OH)3;
根據圖可以看出固體從最大量減少時,只減少了19.4g-11.6g=7.8g也就是氫氧化鋁的質量為7.8g
設與氫氧化鋁反應的氫氧化鈉溶液的體積為x
Al(OH)3+NaOH=NaAlO2+2H2O
78 40
7.8g 200g/L x
$\frac{78}{40}$=$\frac{7.8g}{200g/Lx}$
x=0.02L=20mL
a=160+20=180
沉淀質量達到最大時,由于氯元素和鈉元素守恒,可得100mL稀鹽酸中的HCl的氯元素和氫氧化鈉中的鈉元素都進入了氯化鈉,得關系式為HCl~~~NaCl~~~NaOH
由于至沉淀最大量時,消耗的氫氧化鈉溶液只有160mL即為0.16L,其中溶質氫氧化鈉的質量為200g/L×0.16L=32g
設稀鹽酸中溶質HCl的質量為x
HCl~~~NaCl~~~NaOH
36.5 40
x 32g
$\frac{36.5}{40}$=$\frac{x}{32g}$
x=29.2g
答:(1)生成的19.4g沉淀的化學式是 Mg(OH)2和Al(OH)3;
(2)圖中a=180;
(3)鹽酸溶液溶質的質量是 29.2g.
點評 根據化學方程式計算時,第一要正確書寫化學方程式,第二要使用正確的數據,第三計算過程要完整.


 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源: 題型:推斷題

查看答案和解析>>
科目:初中化學 來源: 題型:填空題
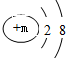 ,其微粒符號可表示為A2-,則m的值為8.
,其微粒符號可表示為A2-,則m的值為8.查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | Zn (NO3)2、AgNO3 | B. | Zn (NO3)2、Cu (NO3)2、AgNO3 | ||
| C. | Zn (NO3)2、Cu (NO3)2、 | D. | Zn (NO3)2 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
| A | B | C | D |
| E |

查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 反應①中,C是還原劑 | B. | 高純硅是金屬單質 | ||
| C. | ②③的目的是將粗硅提純 | D. | ①②③都屬于置換反應類型 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
 能源和環境問題日益成為人們關注的焦點.
能源和環境問題日益成為人們關注的焦點.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com