解:(1)由銅轉化為氧化銅,可采取在空氣中對銅進行加熱,銅與氧氣化合則可生成氧化銅,反應的化學方程式為2Cu+O
2
2CuO;
氧化銅可與稀硫酸發生反應,反應生成硫酸銅和水,反應的化學方程式為CuO+H
2SO
4=CuSO
4+H
2O;
(2)甲方案中放出的有毒氣體二氧化硫會造成對空氣的污染,因此,從保護環境的角度來看,甲方案就不夠合理;根據生成硫酸銅反應的化學方程式可以看到,生成相同物質的量的硫酸銅,消耗硫酸的物質的量甲方案也是乙方案有兩倍,因此從節約原料的角度來看,甲方案也不夠合理.
故答案為:
(1)①2Cu+O
2
2CuO;②CuO+H
2SO
4=CuSO
4+H
2O.
(2)乙方案較合理.用甲方案會產生污染環境的SO
2氣體,且制取等量的CuSO
4時,甲方案消耗的H
2SO
4是乙方案的兩倍.
分析:(1)根據銅、氧化銅的化學性質,判斷由銅生成氧化銅及由氧化銅轉化為硫酸銅所發生的反應,寫出反應的化學方程式;
(2)從保護環境和節約原料的角度看,即要求對反應生成物是否污染空氣進行判斷,還需要對反應中所耗反應物進行量的對比;根據反應的化學方程式,不難判斷甲方案中二氧化硫會污染空氣,而通過對比反應中硫酸銅與硫酸的質量關系,則是判斷所耗原料量的關鍵.
點評:本題既考查了物質的性質、化學方程式的書寫,還對反應的化學方程式所反映出的物質的質量關系進行“隱性”考查,解答時要注意審題.

 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O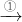 CuO
CuO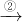 CuSO4的反應過程
CuSO4的反應過程 2CuO;
2CuO; 2CuO;②CuO+H2SO4=CuSO4+H2O.
2CuO;②CuO+H2SO4=CuSO4+H2O.

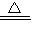 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O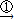 CuO
CuO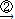 CuSO4的反應過程
CuSO4的反應過程