【答案】
分析:【建立假設】根據氫氧化鈉易吸收空氣中的二氧化碳反應生成碳酸鈉而變質猜想;
【設計實驗】根據碳酸鹽能與稀鹽酸反應生成二氧化碳氣體來驗證;
【反思與思考】(1)根據氫氧化鈉可能是部分變質分析;
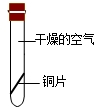
(2)根據潮解的定義分析:暴露在空氣中的固體物質吸收空氣中的水蒸氣而逐漸溶解的現象;
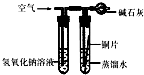
(3)利用反應物中的氫氧化鈉溶液能與二氧化碳反應的有關原理解決該問題,假設使用該裝置則反應時氫氧化鈉會與二氧化碳反應使左邊的物質質量增加,天平不會平衡;
(4)為得到純凈的氫氧化鈉,可利用碳酸鈉能與氫氧化鈣生成氫氧化鈉的變化關系,向溶液中加入適量的氫氧化鈣溶液;
(5)在本題中首先根據溶質的質量分數公式求硫酸鈉的質量,然后根據化學方程式中,已知硫酸鈉的質量求氫氧化鈉和硫酸的質量,再根據硫酸的溶質計算硫酸的質量分數.
解答:解:【建立假設】氫氧化鈉易吸收空氣中的二氧化碳反應生成碳酸鈉而變質,故該固體可能是碳酸鈉;
【設計實驗】碳酸鈉能與稀鹽酸反應生成二氧化碳氣體來檢驗含有碳酸根離子;故為:
| 實驗方法及操作 | 可能觀察到的現象 | 實驗結論 |
| 取白色粉末少許置于試管中加稀鹽酸 | 有氣泡產生 | 有碳酸鈉存在 |
【反思與思考】(1)若氫氧化鈉是完全變質,則表示固體只有碳酸鈉,若是部分變質則含有碳酸鈉和氫氧化鈉;
(2)暴露在空氣中的固體物質吸收空氣中的水蒸氣而逐漸溶解的現象叫潮解,因此這個現象說明了空氣中含有水蒸氣;
(3)在硫酸銅與氫氧化鈉反應的同時,由于氫氧化鈉能與二氧化碳反應,會使溶液的質量增加,導致天平不會平衡,因此設計不嚴密;
(4)為除去溶液中的碳酸鈉而得到純凈的氫氧化鈉溶液,向溶液中加入適量的氫氧化鈣溶液,使變質形成的碳酸鈉再轉化為氫氧化鈉,為不引入新的雜質所加氫氧化鈣溶液要恰好完全反應;此時反應的化學方程式為Na
2CO
3+Ca(OH)
2=CaCO
3↓+2NaOH;
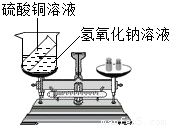
(5)解:142g硫酸鈉溶液中含有硫酸鈉的質量:142g×10%=14.2g
設樣品中含氫氧化鈉的質量為x;稀硫酸中硫酸的質量為y.
2NaOH+H
2SO
4=Na
2SO
4+2H
2O
80 98 142
x y 14.2g
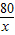
=
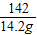
x=8g
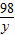
=
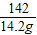
y=9.8g
稀硫酸的溶質質量分數為:
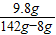
×100%=7.3%
答:樣品中氫氧化鈉的質量是8g;加入的稀硫酸的溶質質量分數是7.3%.
故答案為:【建立假設】白色粉末可能是碳酸鈉;
【設計實驗】
| 實驗方法及操作 | 可能觀察到的現象 | 實驗結論 |
| 取白色粉末少許置于試管中加稀鹽酸 | 有氣泡產生,生成的氣體能使澄清石灰水變渾濁 | 有碳酸鈉存在 |
【反思與思考】(1)氫氧化鈉和碳酸鈉的混合物;(2)水蒸氣;(3)該設計不嚴密,因為氫氧化鈉能與空氣中的二氧化碳反應會使溶液的質量增加,使結果不準確;(4)Na
2CO
3+Ca(OH)
2=CaCO
3↓+2NaOH;
(5)解:142g硫酸鈉溶液中含有硫酸鈉的質量:142g×10%=14.2g
設樣品中含氫氧化鈉的質量為x;稀硫酸中硫酸的質量為y.
2NaOH+H
2SO
4=Na
2SO
4+2H
2O
80 98 142
x y 14.2g
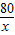
=
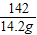
x=8g
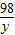
=
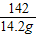
y=9.8g
稀硫酸的溶質質量分數為:
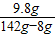
×100%=7.3%
答:樣品中氫氧化鈉的質量是8g;加入的稀硫酸的溶質質量分數是7.3%.
點評:此題重點考查了氫氧化鈉與二氧化碳反應的性質,以及碳酸鹽的檢驗方法,并根據質量守恒定律的探究來說明氫氧化鈉易變質的性質,另外還考查了根據化學方程式的計算來研究氫氧化鈉與酸反應的性質,綜合性較強,要求要對常見的酸、堿、鹽等的性質熟練掌握.

 =
=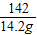 x=8g
x=8g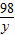 =
=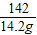 y=9.8g
y=9.8g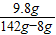 ×100%=7.3%
×100%=7.3%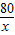 =
=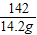 x=8g
x=8g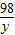 =
=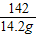 y=9.8g
y=9.8g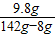 ×100%=7.3%
×100%=7.3%

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案