
 我校化學興趣小組同學為了測定石灰石中碳酸鈣的質量分數,將15g石灰石樣品加入到73g稀鹽酸中恰好完全反應(雜質不溶于水,也不與鹽酸反應),產生CO2氣體的情況如圖所示.計算:
我校化學興趣小組同學為了測定石灰石中碳酸鈣的質量分數,將15g石灰石樣品加入到73g稀鹽酸中恰好完全反應(雜質不溶于水,也不與鹽酸反應),產生CO2氣體的情況如圖所示.計算:分析 (1)根據反應曲線圖,充分反應放出二氧化碳的質量為4.4g,用反應的化學方程式,由生成二氧化碳的質量計算樣品中碳酸鈣的質量,碳酸鈣質量與樣品質量比即為樣品中碳酸鈣含量;
(2)由放出二氧化碳的質量,利用反應的化學方程式,計算出恰好完全時所加73g稀鹽酸中溶質質量,再使用溶質質量分數公式計算出所用稀鹽酸的質量分數;
(3)根據二氧化碳的質量可求出生成的氯化鈣的質量,所得溶液的質量=反應前各組份的質量之和-氣體的質量-雜質的質量,并據溶質的質量分數解答.
解答 解:設樣品中CaCO3的質量為x,參加反應的稀鹽酸中HCl的質量為y,生成氯化鈣得知量為z
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 73 111 44
x y z 4.4g
$\frac{100}{x}=\frac{73}{y}=\frac{111}{z}=\frac{44}{4.4g}$
x=10g,y=7.3g,z=11.1g
(1)樣品中CaCO3的質量分數為:$\frac{10g}{15g}$×100%≈66.7%;
(2)該稀鹽酸中溶質的質量分數是:$\frac{7.3g}{73g}$×100%=10%;
(3)恰好完全反應后所得溶液的質量是:10g+73g-4.4g=78.6g;
反應完全后溶液中溶質的質量分數是:$\frac{11.1g}{78.6g}$×100%=14.1%
答:(1)66.7%;
(2)10%;
(3)反應完全后溶液中溶質的質量分數是14.1%.
點評 本題考查了根據溶質質量分數公式以及反應的化學方程式的計算,完成此題,可以依據已有的知識進行.在對數形結合類問題中的表示變化的曲線進行分析時,曲線的折點的特殊意義是分析的重點.


科目:初中化學 來源: 題型:實驗探究題
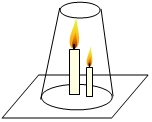 對“高低不同的燃著的蠟燭罩上玻璃杯后,誰先熄滅?”這一問題,甲、乙兩同學有不同的認識:甲同學認為高的蠟燭先熄滅,乙同學認為低的蠟燭先熄滅.他們設計了如圖所示的實驗來驗證自己的猜想.
對“高低不同的燃著的蠟燭罩上玻璃杯后,誰先熄滅?”這一問題,甲、乙兩同學有不同的認識:甲同學認為高的蠟燭先熄滅,乙同學認為低的蠟燭先熄滅.他們設計了如圖所示的實驗來驗證自己的猜想.查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
 我國礦產資源豐富,銦的生產規模較大.圖1是元素周期表中銦元素的信息,圖2是銦原子的結構示意圖.回答下列問題.
我國礦產資源豐富,銦的生產規模較大.圖1是元素周期表中銦元素的信息,圖2是銦原子的結構示意圖.回答下列問題.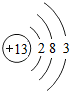 ,該元素與銦元素在元素周期上處于同一個族.
,該元素與銦元素在元素周期上處于同一個族.查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | CO(NH2)2 | B. | NH4H2PO4 | C. | KCl | D. | Ca3(PO4)2 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com