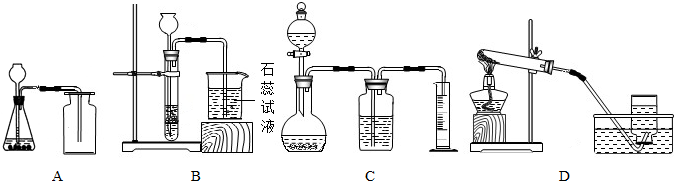
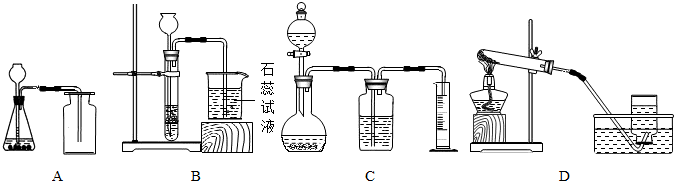
解:(1)用KMnO
4固體制取O
2,是固體的加熱反應,所以我們可以用裝置D作為實驗裝置;根據反應物是高錳酸鉀、反應條件是加熱寫出化學反應式是:2KMnO
4 
K
2MnO
4+MnO
2+O
2↑;實驗結束時,為防止水倒流入試管,引起試管炸裂,要先移出導管,再熄滅酒精燈.
故答案為:B、2KMnO
4 
K
2MnO
4+MnO
2+O
2↑、先把導氣管移出水面,再熄滅酒精燈;
(2)裝置A適合固體和液體在常溫下反應,氧氣和二氧化碳都可以在此裝置中制取.過氧化氫溶液與二氧化錳固體反應制取氧氣.大理石固體和稀鹽酸液體反應制取二氧化碳氣體.所以它制取的氣體可能是CO
2或O
2;我們可以根據氧氣支持燃燒,二氧化碳不支持燃燒的特點來檢驗是哪種氣體,可用燃著的木條伸入集氣瓶中,若木條熄滅為CO
2,若木條燃燒更旺為O
2.
故答案為:CO
2或O
2、用燃著的木條伸入集氣瓶中,若木條熄滅為CO
2,若木條燃燒更旺為O
2;
(3)從圖示可知,C裝置的燒杯中盛放的是石蕊試液,它遇酸變紅.二氧化碳不能直接使石蕊試液變紅,所以a不合理;產生的CO
2與H
2O反應生成H
2CO
3,使紫色石蕊試液變紅,是正確的;揮發出的氯化氫溶于水,使溶液呈酸性,使紫色石蕊試液變紅,是正確的.
故選a;
(4)測量體積要用量筒,能測量體積的只有裝置C;如果滴入的液體如果具有揮發性,就會混入生成的氣體中,使得測量的值偏大.
故答案為:C、包含了滴入液體的體積.
分析:(1)用KMnO
4固體制取O
2,是固體的加熱反應,據此選擇實驗發生裝置;然后根據反應物是KMnO
4和反應條件是加熱寫出化學反應式;實驗結束時,為防止水倒流入試管,要先移出導管,再熄滅酒精燈;
(2)裝置A適合固體和液體在常溫下反應,我們所了解的氣體中的氧氣和二氧化碳都可以在此裝置中制取,據此寫出可制取的氣體;根據制取的氣體的性質,選擇驗滿的方法;
(3)先觀察圖形,可知B裝置的燒杯中盛放的是石蕊試液,它遇酸變紅.然后在選項abc中哪一個的解釋不合理,就選哪一個.
(4)測量體積要用量筒;滴入的液體占有一定的體積,導致生成的氣體體積偏大.
點評:發生裝置的選擇要考慮反應物的狀態和反應條件,氣體收集裝置的選擇要看收集氣體的密度和溶水性,這些是化學實驗中的常見問題,同學們一定要記清.

 K2MnO4+MnO2+O2↑;實驗結束時,為防止水倒流入試管,引起試管炸裂,要先移出導管,再熄滅酒精燈.
K2MnO4+MnO2+O2↑;實驗結束時,為防止水倒流入試管,引起試管炸裂,要先移出導管,再熄滅酒精燈. K2MnO4+MnO2+O2↑、先把導氣管移出水面,再熄滅酒精燈;
K2MnO4+MnO2+O2↑、先把導氣管移出水面,再熄滅酒精燈;

 閱讀快車系列答案
閱讀快車系列答案