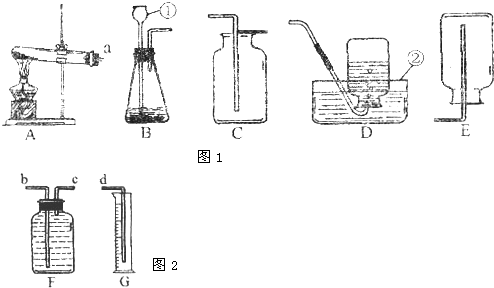
解:(1)要熟記常見儀器的名稱:①長頸漏斗;②水槽;
(2)制取H
2是用固態的鋅粒和液態的稀硫酸在常溫下不需要加熱,故發生裝置的特點屬于反應物的狀態是固體和液體,不需要加熱的B;用D排水法或E向下排空氣法裝置收集H
2,說明H
2具有不易溶于水,密度比空氣小的性質;
(3)氧化氫溶液在催化劑的作用下分解生成水和氧氣,反應的方程式是2H
2O
2
2H
2O+O
2↑;氧氣難溶于水,可用排水法收集,欲得到較純凈的氧氣,選用排水法收集,氧氣密度比空氣大,收集滿后集氣瓶要正放在桌面上;
(4)高錳酸鉀分解生成錳酸鉀、二氧化錳、氧氣,反應的化學方程式是2KMnO
4
K
2MnO
4+MnO
2+O
2↑;
(5)該裝置是利用排水法收集氧氣,且通過量筒測定水的體積從而知道氣體的體積,故產生的氧氣通過短管進入,把水排入量筒;
故答案為:(1)長頸漏斗;水槽;
(2)B;不易溶于水,密度比空氣小;
(3)2H
2O
2
2H
2O+O
2↑;排水;正放;
(4)2KMnO
4
K
2MnO
4+MnO
2+O
2↑;
(5)c;b.
分析:(1)熟練掌握常見化學儀器的名稱及其用途;
(2)根據反應物的狀態和反應條件來選擇發生裝置;根據氣體的密度和溶解性選擇相應的收集方法;
(3)根據過氧化氫溶液制取氧氣的反應原理結合氧氣的性質分析考慮;
(4)根據用高錳酸鉀制取O
2的實驗原理分析考慮;
(5)根據測定氣體體積的原理分析.
點評:本題考查了常見氣體的制取和收集以及實驗的注意事項等,難度不大,但關鍵是明確實驗的原理.


 2H2O+O2↑;氧氣難溶于水,可用排水法收集,欲得到較純凈的氧氣,選用排水法收集,氧氣密度比空氣大,收集滿后集氣瓶要正放在桌面上;
2H2O+O2↑;氧氣難溶于水,可用排水法收集,欲得到較純凈的氧氣,選用排水法收集,氧氣密度比空氣大,收集滿后集氣瓶要正放在桌面上; K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑; 2H2O+O2↑;排水;正放;
2H2O+O2↑;排水;正放; K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;