
 ×100%進行解答;
×100%進行解答; ×100%,所以CO(NH2)2中氮元素的質量分數是
×100%,所以CO(NH2)2中氮元素的質量分數是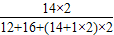 ×100%=
×100%=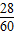 ×100%=46.7%.
×100%=46.7%.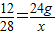


科目:初中化學 來源: 題型:
| ||
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com