
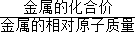 ×金屬質量,計算生成0.2g氫氣消耗選項所涉及金屬鐵、鋅、鎂、鋁的質量;然后根據題設的條件:兩種金屬混合物5g,與足量稀硫酸反應后生成了0.2 g氫氣,推斷出兩種金屬混合物的可能組成.
×金屬質量,計算生成0.2g氫氣消耗選項所涉及金屬鐵、鋅、鎂、鋁的質量;然后根據題設的條件:兩種金屬混合物5g,與足量稀硫酸反應后生成了0.2 g氫氣,推斷出兩種金屬混合物的可能組成.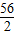 =5.6g;需要金屬鋅的質量0.2g×
=5.6g;需要金屬鋅的質量0.2g×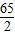 =6.5g;需要金屬鎂的質量=0.2g×
=6.5g;需要金屬鎂的質量=0.2g×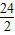 =2.4g;需要金屬鋁的質量=0.2g×
=2.4g;需要金屬鋁的質量=0.2g×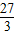 =1.8g;銅銀不與稀硫酸反應;根據金屬混合物與酸反應產生氣體質量為兩種金屬反應產生氫氣質量和,由實際實驗中兩種金屬混合物5g與足量稀硫酸反應后生成了0.2g氫氣,可判斷選項混合物中兩種金屬只可能為金屬銅與鋁的混合物或鎂和鋅的混合物;
=1.8g;銅銀不與稀硫酸反應;根據金屬混合物與酸反應產生氣體質量為兩種金屬反應產生氫氣質量和,由實際實驗中兩種金屬混合物5g與足量稀硫酸反應后生成了0.2g氫氣,可判斷選項混合物中兩種金屬只可能為金屬銅與鋁的混合物或鎂和鋅的混合物;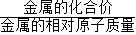 ×金屬質量,利用該公式進行計算時,需要注意到鐵在與酸發生置換反應時呈現出+2價.
×金屬質量,利用該公式進行計算時,需要注意到鐵在與酸發生置換反應時呈現出+2價. 

科目:初中化學 來源:不詳 題型:單選題
| A.Al、Fe | B.Cu、Zn | C.Mg、Al | D.Fe、Ag |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com