
 小明想測定Cu-Zn合金和Cu-Ag合金中銅的質量分數,實驗室只提供一瓶稀鹽酸和必要的儀器.
小明想測定Cu-Zn合金和Cu-Ag合金中銅的質量分數,實驗室只提供一瓶稀鹽酸和必要的儀器.分析 (1)在金屬活動性順序中,氫前的金屬能與酸反應生成氫氣,利用氫氣的質量根據相應的反應方程式即可求得合金中鋅的質量,從而求得銅的質量和其含量,據此分析問題即可.
(2)根據生成的氫氣的質量和對應的化學方程式求算反應的鋅的質量,進而求算銅合金中銅的質量分數.
解答 解:(1)Cu-Zn合金中鋅在氫的前面,能與鹽酸反應生成氫氣,而銅不與鹽酸反應生成氫氣,依據氫氣的質量可求鋅的質量,進而能測出銅的質量分數;Cu-Ag中的金屬都不與鹽酸反應生成氫氣,因此不能測出銅的質量分數;
故答案為:Zn;Cu-Zn.
(2)根據圖可以看出生成的氫氣的質量為0.2g;
根據鋅在氫的前面,能與鹽酸反應生成氫氣的特點,向該合金中繼續加入鹽酸,如果不再有氣泡冒出,說明該合金和鹽酸已充分反應.
設參加反應的鋅的質量為x,
Zn+2HCl=ZnCl2+H2↑
65 2
x 0.2g
$\frac{65}{x}=\frac{2}{0.2g}$
x=6.5g
則合金中銅的質量為10g-6.5g=3.5g
該銅合金中銅的質量分數$\frac{3.5g}{10g}$×100%=35%
答:(1)0.2;向該合金中繼續加入鹽酸,如果不再有氣泡冒出,說明該合金和鹽酸已充分反應;
(2)該銅合金中銅的質量分數為35%.
點評 本題難度不是很大,主要考查了質量守恒定律的應用和根據化學方程式的計算,培養學生分析問題的能力和解決問題的能力.


 海淀課時新作業金榜卷系列答案
海淀課時新作業金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 輕松課堂標準練系列答案
輕松課堂標準練系列答案科目:初中化學 來源: 題型:填空題

查看答案和解析>>
科目:初中化學 來源: 題型:選擇題

| A. | 鈦酸亞鐵(FeTiO3)中鈦元素化合價為+3價 | |
| B. | ①中反應是氧化還原反應 | |
| C. | ③中氬氣(Ar)作反應物 | |
| D. | ②中為使原料全部轉化為甲醇,理論上CO和H2投料的質量比為14:1 |
查看答案和解析>>
科目:初中化學 來源: 題型:多選題
| A. | NaCl NaOH NaNO3 | B. | NaOH H2SO4 KNO3 | ||
| C. | HCl NaCl Na2SO4 | D. | NaCl BaSO4 CuSO4 |
查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
 A、B…H八種物質,有下圖所示關系:A為暗紫色固體,E和F組成元素相同且常溫下均為無色液體,G是一種銀白色金屬,H是一種黑色固體,在②的反應前后B的質量和化學性質都不改變.試推斷:
A、B…H八種物質,有下圖所示關系:A為暗紫色固體,E和F組成元素相同且常溫下均為無色液體,G是一種銀白色金屬,H是一種黑色固體,在②的反應前后B的質量和化學性質都不改變.試推斷:查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
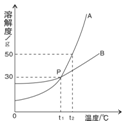 根據如圖中a、b兩種物質的溶解度曲線,回答下列問題:
根據如圖中a、b兩種物質的溶解度曲線,回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com