
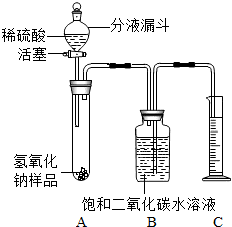
 某學生為了測定實驗室中一瓶因保存不善而部分變質的氫氧化鈉中碳酸鈉的質量分數,設計了如圖所示的裝置(圖中鐵架臺已略去),實驗在27℃,101kPa下進行,實驗步驟如下:
某學生為了測定實驗室中一瓶因保存不善而部分變質的氫氧化鈉中碳酸鈉的質量分數,設計了如圖所示的裝置(圖中鐵架臺已略去),實驗在27℃,101kPa下進行,實驗步驟如下: L×1.8 g/L=0.396 g
L×1.8 g/L=0.396 g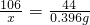 ,解之得:x=0.954g
,解之得:x=0.954g ×100%=47.7%
×100%=47.7%

科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
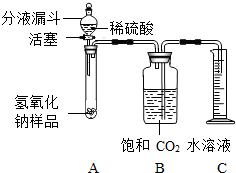
 某學生為了測定實驗室中一瓶因保存不善而部分變質的氫氧化鈉中碳酸鈉的質量分數,設計了如圖所示的裝置(圖中鐵架臺已略去),實驗在27℃,101kPa下進行,實驗步驟如下:
某學生為了測定實驗室中一瓶因保存不善而部分變質的氫氧化鈉中碳酸鈉的質量分數,設計了如圖所示的裝置(圖中鐵架臺已略去),實驗在27℃,101kPa下進行,實驗步驟如下:查看答案和解析>>
科目:初中化學 來源: 題型:
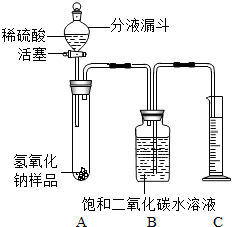
 某學生為了測定實驗室中一瓶因保存不善而部分變質的氫氧化鈉中碳酸鈉的質量分數,設計了如下圖所示的裝置(圖中鐵架臺已略去),實驗在27℃,101kPa下進行,實驗步驟如下:
某學生為了測定實驗室中一瓶因保存不善而部分變質的氫氧化鈉中碳酸鈉的質量分數,設計了如下圖所示的裝置(圖中鐵架臺已略去),實驗在27℃,101kPa下進行,實驗步驟如下:查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
 某學生為了測定實驗室中一瓶因保存不善而部分變質的氫氧化鈉中碳酸鈉的質量分數,設計了如圖所示的裝置(圖中鐵架臺已經略去),實驗在27℃,101kPa下進行,實驗步驟如下:
某學生為了測定實驗室中一瓶因保存不善而部分變質的氫氧化鈉中碳酸鈉的質量分數,設計了如圖所示的裝置(圖中鐵架臺已經略去),實驗在27℃,101kPa下進行,實驗步驟如下:| 實驗步驟 | 實驗現象 | 實驗結論 |
| 步驟一: 取樣,溶于水,滴加 過量的氯化鈣溶液 取樣,溶于水,滴加 過量的氯化鈣溶液 |
有白色沉淀產生 有白色沉淀產生 |
氫氧化鈉部分變質 |
| 步驟二: 靜置,向上清液中滴加 酚酞 靜置,向上清液中滴加 酚酞 |
變紅 變紅 |
查看答案和解析>>
科目:初中化學 來源:2006年江蘇省泰州市泰興市洋思中學九年級化學實驗與探究專項練習試卷(4月份)(解析版) 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com