
| 次數 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的質量/g | 35.0 | 35.0 | 35.0 | 35.0 |
| 剩余固體的質量/g | 6.821 | 5.6 | 4.4 | 4.2 |
分析 (1)銅不能與酸發生置換反應,因此,當金屬混合物粉末與足量稀硫酸完全反應后,剩余固體質量即為銅的質量;
(2)由于35克硫酸參加反應金屬每減少1.2克,由此可以求出第四次參加反應硫酸的質量,根據參加反應金屬的質量與參加反應硫酸的質量計算金屬的相對原子質量;根據相對原子質量判斷金屬元素;
(3)第三次加入硫酸充分反應后,由于金屬有剩余因而所加稀硫酸完全反應,所得溶液為金屬的硫酸鹽溶液;根據反應的化學方程式則消耗金屬的質量計算出反應生成硫酸鹽的質量,所得質量與溶液的質量比即得溶液的質量分數;反應后所得溶液的質量由質量守恒定律進行求得.
解答 解:
(1)分析表格發現,前三次每加入35g硫酸,剩余固體的質量就減少1.2g,但是第四次加入35g硫酸,剩余固體的質量減少0.2g,說明另一種金屬已經全部參加反應,剩余固體就是銅,所以銅的質量為4.2g.該混合物粉末中銅的質量分數=$\frac{4.2g}{8g}$×1005=52.5%;
(2)設該金屬的相對分子質量為X,該金屬為M.
以第一次加入35g硫酸為例,純硫酸的質量是35g×14%=4.9g.
M+H2SO4═MSO4+H2↑
x 98
1.2g 4.9g
$\frac{x}{1.2g}=\frac{98}{4.9g}$
∴解得x=24,
根據相對原子質量表,則該金屬為Mg.
(3)設MgSO4的質量為y,H2的質量為z.
第三次加入硫酸以后,總共加入硫酸的質量是35g×3=105g,則純硫酸的質量是105g×14%═14.7gg.
Mg+H2SO4═MgSO4+H2↑
98 120 2
14.7g y z
$\frac{98}{14.7g}=\frac{120}{y}=\frac{2}{z}$
y=18g
z=0.3g
MgSO4溶液的質量分數為:$\frac{18g}{105g+3.6g-0.3g}$×100%≈16.6%
答:該混合物粉末中銅的質量分數是52.5%;該混合物粉末中另一金屬為金屬鎂;第三次加入硫酸充分反應后,所得溶液中溶質的質量分數是16.6%.
點評 根據質量守恒定律,第三次加入稀硫酸充分反應后所得溶液的質量=參加反應金屬的質量+三次所加稀硫酸的質量-反應放出氫氣的質量;利用根據守恒定律化復雜的溶液計算為簡便明了.


 名牌學校分層周周測系列答案
名牌學校分層周周測系列答案 黃岡海淀全程培優測試卷系列答案
黃岡海淀全程培優測試卷系列答案科目:初中化學 來源: 題型:解答題
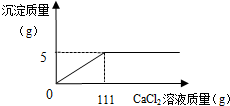 某碳酸鈉和氯化鈉的混合粉末21.2g,不斷加入CaCl2溶液,產生沉淀的質量與所加入的CaCl2溶液的關系如圖所示.
某碳酸鈉和氯化鈉的混合粉末21.2g,不斷加入CaCl2溶液,產生沉淀的質量與所加入的CaCl2溶液的關系如圖所示.查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
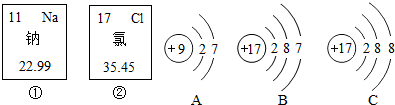
查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| 物質 | 甲 | 乙 | 丙 | 丁 |
| 反應前的質量(g) | 4.0 | 2.0 | 3.0 | 2.0 |
| 反應后的質量(g) | 1.2 | x | 2.4 | 5.4 |
| A. | X=2.0,乙可能是催化劑 | B. | 甲和丙是反應物 | ||
| C. | 丁一定是化合物 | D. | 參加反應的甲、丙質量比是1:2 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
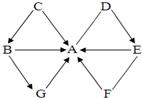 如圖中A~G均是初中化學常見物質,它們之間的轉化或相互反應關系均為初中常見反應,其中G屬于單質,且被稱為最理想能源,其余均為化合物,B和C物質類別相同,D、E溶于水所得溶液的pH大于7.圖中“-”表示兩端的物質能發生化學反應,“→”表示物質間存在轉化關系,反應條件、部分反應物和生成物已略去.
如圖中A~G均是初中化學常見物質,它們之間的轉化或相互反應關系均為初中常見反應,其中G屬于單質,且被稱為最理想能源,其余均為化合物,B和C物質類別相同,D、E溶于水所得溶液的pH大于7.圖中“-”表示兩端的物質能發生化學反應,“→”表示物質間存在轉化關系,反應條件、部分反應物和生成物已略去.查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 研制生產可降解塑料的主要目的是解決“白色污染”問題 | |
| B. | 區分硬水和軟水可用肥皂水 | |
| C. | 煤燃燒過程中產生的二氧化硫是引起溫室效應的主要物質 | |
| D. | 加入活性炭可除去水中的異味和色素 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com