
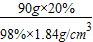 =10mL;
=10mL;

 全優(yōu)沖刺100分系列答案
全優(yōu)沖刺100分系列答案 英才點(diǎn)津系列答案
英才點(diǎn)津系列答案
| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:初中化學(xué) 來(lái)源: 題型:


查看答案和解析>>
科目:初中化學(xué) 來(lái)源: 題型:
 22、實(shí)驗(yàn)室提供了①天平②量筒③燒杯④玻璃棒⑤酒精燈等儀器,小華同學(xué)用固體氯化鈉配制10%的氯化鈉溶液,小亮同學(xué)用濃鹽酸配制10%的稀鹽酸.
22、實(shí)驗(yàn)室提供了①天平②量筒③燒杯④玻璃棒⑤酒精燈等儀器,小華同學(xué)用固體氯化鈉配制10%的氯化鈉溶液,小亮同學(xué)用濃鹽酸配制10%的稀鹽酸.查看答案和解析>>
科目:初中化學(xué) 來(lái)源: 題型:

查看答案和解析>>
科目:初中化學(xué) 來(lái)源: 題型:
查看答案和解析>>
科目:初中化學(xué) 來(lái)源: 題型:
 實(shí)驗(yàn)室提供了①天平 ②量筒 ③燒杯 ④玻璃棒 ⑤酒精燈 ⑥蒸發(fā)皿等儀器,小明同學(xué)用固體氯化鈉配制20%的氯化鈉溶液,小亮同學(xué)用濃鹽酸配制20%的稀鹽酸.
實(shí)驗(yàn)室提供了①天平 ②量筒 ③燒杯 ④玻璃棒 ⑤酒精燈 ⑥蒸發(fā)皿等儀器,小明同學(xué)用固體氯化鈉配制20%的氯化鈉溶液,小亮同學(xué)用濃鹽酸配制20%的稀鹽酸.查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com