
分析 根據質量守恒定律可知,反應前后固體的質量之差為氧氣的質量,然后將氧氣的質量代入化學反應方程式來計算氯化鉀的質量及二氧化錳的質量,進而計算二氧化錳的質量分數.
解答 解:(1)由質量守恒定律可知,生成氧氣的質量為:15.5g-10.7g=4.8g;
(2)設生成氯化鉀的質量為x
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
245 96
x 4.8g
$\frac{245}{x}$=$\frac{96}{4.8g}$
x=12.25g
所以剩余固體中MnO2的質量為15.5g-12.25g=2.25g,因為催化加在化學反應前后質量不變,所以剩余固體中二氧化錳的質量分數為$\frac{2.25g}{10.7g}$×100%=21.0%.
故答案為:(1)4.8;
(2)21.0%.
點評 根據質量守恒定律,由反應前后固體物質質量差即反應所產生氧氣的質量;利用二氧化錳為反應的催化劑,反應前后質量不變,由混合物質量與參加反應的氯酸鉀質量差可求得二氧化錳的質量.


科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 應及時回收廢舊金屬 | B. | 應禁止開采金屬礦物 | ||
| C. | 應嚴禁使用金屬材料 | D. | 應大力尋找并開采金屬礦物 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | “碳海綿”是一種化合物 | |
| B. | “碳海綿”具有較強的吸附作用 | |
| C. | “碳海綿”在一定條件下可與氧化銅發生反應 | |
| D. | “碳海綿”在氧氣中完全燃燒的產物是CO2 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
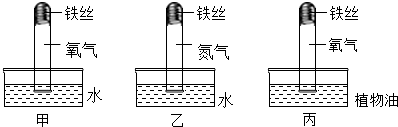
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
 如圖是某胃藥標簽上的部分內容.某中學化學興趣小組的同學們測定該藥品中碳酸氫鈉(NaHCO3)的質量分數,取10片該藥品研碎后放入燒杯中,再向燒杯中滴加稀鹽酸至恰好完全反應(雜質不溶于水,也不參加反應),共消耗稀鹽酸23g.測得反應后燒杯內物質的總質量為25.8g.請計算:
如圖是某胃藥標簽上的部分內容.某中學化學興趣小組的同學們測定該藥品中碳酸氫鈉(NaHCO3)的質量分數,取10片該藥品研碎后放入燒杯中,再向燒杯中滴加稀鹽酸至恰好完全反應(雜質不溶于水,也不參加反應),共消耗稀鹽酸23g.測得反應后燒杯內物質的總質量為25.8g.請計算:查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
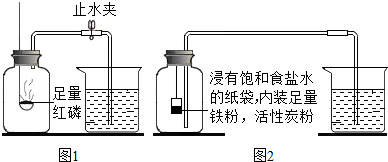
| 測量項目 | 實驗前 | 實驗后 | |
| 集氣瓶(扣除內容物)和導管的容積 | 燒杯中剩余水的體積 | 燒杯中剩余水的體積 | |
| 體積/mL | 126.0 | 80.0 | 54.5 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com