【答案】
分析:(1)溶解度曲線的交點表示該溫度下兩物質的溶解度相同;
(2)溶解度曲線的交點表示該溫度下兩物質的溶解度相同;
(3)據溶解度曲線可以比較同一溫度下不同物質的溶解度大小;
(4)據物質的溶解度曲線及溶質的質量分數分析解答;
(5)據物質的溶解度隨 溫度變化情況分析結晶的方法;
(6)根據飽和時質量分數的計算式

×100%分析解答;
(7)據該溫度下A的溶解度并結合飽和溶液中溶質的質量分數計算方法分析解答;
(8)根據三種物質的溶解度隨溫度變化情況分析降溫后析出晶體的情況;
(9)溫度升高,飽和溶液變渾濁,說明有溶質析出,該物質的溶解度隨溫度的升高而減小.
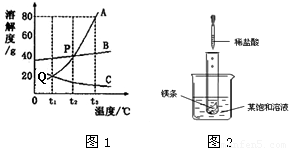
解答:解:(1)Q點表示:t
1℃時A、C的溶解度相同;
(2)P點表示:t
2℃時A、B的溶解度相同;
(3)t
2℃時A、B、C三種物質溶解度由小到大的順序:C<B=A;
(4)A物質的溶解度受溫度影響最大.等質量的三種飽和溶液從t
3℃降溫到t
1℃時,A析出的溶質最多,B其次,而C由于溶解度增大而無晶體析出.而降低到t
1℃時,由于溶解度是B>A,此時雖然C的溶解度大,但由于不是飽和溶液,所以其溶解的物質還是和先前的t
3℃相同,也就是此時計算還是要考慮該溫度下的溶解度,所以在t
1℃,溶解物質的關系就是C<A<B,根據飽和時質量分數的計算式

×100%=

×100%,即溶解度越大質量分數也就越大,所以此時溶液的質量分數關系是:B>A>C;
(5)A的溶解度受溫度影響最大,故要從A物質的飽和溶液中得到A物質,可用降溫結晶或冷卻熱飽和溶液的方法;B的溶解度受溫度影響不大,故要從B物質的飽和溶液中得到B物質,可用蒸發溶劑的方法;
(6)t
2℃時A、B的溶解度相同,故其飽和溶液中溶質的質量分數相等;
(7)由溶解度曲線圖可知:t
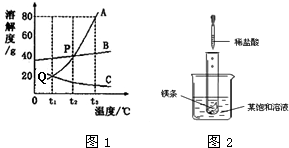
3℃時A的溶解度是80g,所以向100g水中加入90gA物質,充分溶解后最多溶解80g,所得溶液是飽和溶液;溶質的質量分數是:
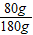
×100%≈44.4%;
(8)將t
2℃時的等質量三種物質的飽和溶液分別降到0℃時,A的溶解度變化差異最大,故析出溶質最多;C的溶解度隨溫度降低而減小,故無溶質析出;
(9)化學反應放熱使燒杯中飽和溶液變渾濁,說明有溶質析出,該物質的溶解度隨溫度的升高而減小,是C物質;
故答案為:(1)t
1℃時A、C的溶解度相同;
(2)t
2℃時A、B的溶解度相同;
(3)C<B=A;
(4)B>A>C;
(5)降溫結晶或冷卻熱飽和溶液;蒸發溶劑;
(6)A;B;
(7)飽和;44.4%;
(8)A;C;
(9)C.
點評:本題綜合考查了學生對溶解度曲線意義的理解和應用,并與溶質的質量分數、飽和溶液等相結合,能很好的考查學生的思維能力.

 ×100%分析解答;
×100%分析解答; ×100%=
×100%= ×100%,即溶解度越大質量分數也就越大,所以此時溶液的質量分數關系是:B>A>C;
×100%,即溶解度越大質量分數也就越大,所以此時溶液的質量分數關系是:B>A>C;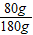 ×100%≈44.4%;
×100%≈44.4%;


 (1)請你各舉出一個實例,說明下列有關溶液的敘述是錯誤的.
(1)請你各舉出一個實例,說明下列有關溶液的敘述是錯誤的. 圖1是A、B、C三種固體物質的溶解度曲線圖,請結合圖示回答下列問題:
圖1是A、B、C三種固體物質的溶解度曲線圖,請結合圖示回答下列問題: