(1)根據鎂在空氣中燃燒的化學方程式求出鎂、氧氣、氧化鎂物質之間的質量比為______.該質量比說明每______份質量的鎂和______份質量的氧氣正好完全反應生成______份質量的氧化鎂.
(2)根據上題的結果推算:2.4g鎂在空氣中完全燃燒后,生成了______g氧化鎂,消耗了______g氧氣.
【答案】
分析:(1)首先正確寫出鎂和氧氣反應的化學方程式并配平,利用各物質之間的質量比等于相對分子質量和的比解決問題即可
(2)根據(1)中計算出的反應物與生成物的質量比和其中一項的質量,就可計算出其它物質的質量.
解答:解:(1)化學反應中各物質之間的質量比等于相對分子質量和的比.
鎂和氧氣反應的化學方程式為:
2Mg+O
2 
2MgO
48 32 80
故鎂、氧氣、氧化鎂的質量比是48:32:80.化簡后為3:2:5;
(2)根據上述化學方程式,設2.4gMg完全燃燒生成氧化鎂的質量為x,消耗氧氣的質量為y
2Mg+O
2 
2MgO
48 32 80
2.4g y x
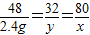
x=4g y=1.6g
故答案為:4;1.6
點評:此題是利用化學方程式的計算,主要是利用了化學反應中各物質之間的質量比等于相對分子質量和的比,屬于基礎題型.

 2MgO
2MgO 2MgO
2MgO