
分析 因為反應時雜質不會參與反應,所以恰好反應后剩余的雜質即為大理石中雜質的質量,據此可知樣品中碳酸鈣的質量;利用方程式以及碳酸鈣的質量可以求出生成氯化鈣的質量;根據生成的氯化鈣質量以及所得溶液的質量即可求出反應后所得溶液中溶質的質量分數.
解答 解:(1)根據反應后雜質的質量為5g,所以大理石中碳酸鈣的質量為12.5g-2.5g=10.0g,則大理石中碳酸鈣的質量分數為:$\frac{10.0g}{12.5g}$×100%=80%;
(2)設生成的氯化鈣的質量是y,二氧化碳的質量是x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
10g y x
$\frac{100}{10g}=\frac{111}{y}=\frac{44}{x}$
x=4.4g y=11.1g
反應后所得溶液的質量是10g+100g-4.4g=105.6g,則反應后所得溶液中溶質的質量分數為 $\frac{11.1g}{105.6g}$×100%≈10.5%.
答:(1)大理石中碳酸鈣的質量分數為80%;(2)反應后所得溶液中溶質的質量分數為10.5%.
點評 根據反應的化學方程式進行計算時,所使用的質量均為純凈物的質量,不純物質的質量不能直接代入化學方程式進行計算.


科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A化學與生活 | B化學與安全 |
| ①用洗滌劑去除油污 ②用鑲有金剛石的玻璃刀裁玻璃 ③用生石灰作食品干燥劑 | ①炒菜鍋著火可以用鍋蓋蓋火 ②在室內一盆水能防止煤氣中毒 ③夜間發現液化氣泄漏開燈尋找泄漏源 |
| C化學與資源 | D化學與發現 |
| ①防止金屬腐蝕是保護金屬資源的途徑之一 ②煤、石油、天然氣是可再生能源 ③海洋中蘊藏著豐富的化學資源 | ①波義耳發現酸堿指示劑 ②拉瓦錫發現元素周期律并編制元素周期表 ③門捷列夫發現空氣的組成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
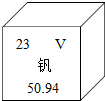 釩被譽為“合金的維生素”,釩元素的相關信息如圖所示.下列有關釩的說法不正確的是( )
釩被譽為“合金的維生素”,釩元素的相關信息如圖所示.下列有關釩的說法不正確的是( )| A. | 屬于金屬元素 | B. | 原子序數為23 | ||
| C. | 原子核外電子數為23 | D. | 相對原子質量為50.94g |
查看答案和解析>>
科目:初中化學 來源: 題型:多選題
| A. | Fe3O4 | B. | Fe3O4和Fe2O3 | ||
| C. | Fe和Fe2O3且質量比為7:20 | D. | FeO和Fe2O3且質量比為9:20 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 濾渣中一定有銀和鐵,可能有銅 | |
| B. | 濾渣中一定有銀,一定沒有銅和鐵 | |
| C. | 濾液中一定有硝酸鎂、硝酸亞鐵、硝酸銅、硝酸銀 | |
| D. | 濾液中一定有硝酸鎂、硝酸亞鐵、硝酸銅、可能有硝酸銀 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com