
 如圖是測定空氣中氧氣含量的實驗裝置,請根據實驗回答問題
如圖是測定空氣中氧氣含量的實驗裝置,請根據實驗回答問題 的氧氣完全消耗,氣體減少了
的氧氣完全消耗,氣體減少了 ,因此可觀察到鐘罩內水面上升;紅磷燃燒的化學方程式為4P+50
,因此可觀察到鐘罩內水面上升;紅磷燃燒的化學方程式為4P+50 2P2O5;
2P2O5; 而不會繼續上升,可說明剩余的氮氣既不溶于水又不能與水發生反應;
而不會繼續上升,可說明剩余的氮氣既不溶于水又不能與水發生反應; ;4P+50
;4P+50 2P2O5;
2P2O5;

 數學奧賽暑假天天練南京大學出版社系列答案
數學奧賽暑假天天練南京大學出版社系列答案科目:初中化學 來源: 題型:
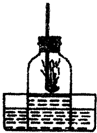 (2002?山東)如圖是測定空氣中氧氣的體積分數的裝置.將一鐘罩放入盛水的水槽中,點燃燃燒匙里的藥品,立即插入鐘罩內,同時塞緊橡皮塞,反應結束后鐘罩內水面上升了1/5體積.現有:①硫粉②紅磷③木炭粉,燃燒匙中的藥品最好選用( )
(2002?山東)如圖是測定空氣中氧氣的體積分數的裝置.將一鐘罩放入盛水的水槽中,點燃燃燒匙里的藥品,立即插入鐘罩內,同時塞緊橡皮塞,反應結束后鐘罩內水面上升了1/5體積.現有:①硫粉②紅磷③木炭粉,燃燒匙中的藥品最好選用( )查看答案和解析>>
科目:初中化學 來源: 題型:
 如圖是測定空氣中氧氣體積分數的實驗裝置.
如圖是測定空氣中氧氣體積分數的實驗裝置.
| ||
| ||
查看答案和解析>>
科目:初中化學 來源: 題型:
 如圖是測定空氣中氧氣的含量的實驗:(友情提示:本實驗采用灼燒銅絲的方法)
如圖是測定空氣中氧氣的含量的實驗:(友情提示:本實驗采用灼燒銅絲的方法)| 1 |
| 5 |
| 1 |
| 5 |
查看答案和解析>>
科目:初中化學 來源: 題型:
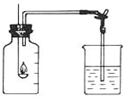 如圖是測定空氣中氧氣含量的裝置圖:
如圖是測定空氣中氧氣含量的裝置圖:| 1 |
| 5 |
| 1 |
| 5 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com