(2009?貴港)酸和堿能發生中和反應,它在日常生活和工農業生產中有廣泛的應用.小強同學在做中和反應實驗時,向盛有40g10%的氫氧化鈉溶液的燒杯中逐滴加入稀鹽酸,當恰好完全反應時,共滴加了36.5g稀鹽酸.
(1)配置40g10%的氫氧化鈉溶液需要水______mL.(ρ水=1.0g/mL)
(2)求:所加稀鹽酸的溶質質量分數和反應后所得溶液中溶質的質量.(寫出計算過程)
【答案】
分析:(1)由氫氧化鈉溶液的質量和溶質質量分數可以計算出溶液中溶劑的質量.
(2)由氫氧化鈉溶液的質量和溶質質量分數、稀鹽酸的質量,根據化學方程式可以計算出稀鹽酸的溶質質量分數和生成氯化鈉的質量.
解答:解:(1)需要水的體積為
40g×(1-10%)÷1.0g/mL=36mL
(2)設稀鹽酸中溶質的質量分數為x,反應生成的NaCl的質量為y
NaOH+HCl=NaCl+H
2O
40 36.5 58.5
40g×10% 36.5g×x y

=
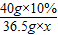
,x=10%
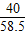
=
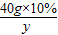
,y=5.85g
答:所加稀鹽酸的溶質質量分數為10%;反應后所得溶液中溶質的質量為5.85g.
點評:本題主要考查含雜質物質的化學方程式計算和溶質質量分數的計算,難度較大.

 =
=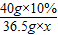 ,x=10%
,x=10%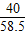 =
=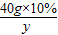 ,y=5.85g
,y=5.85g

 閱讀快車系列答案
閱讀快車系列答案