
分析 (1)根據溶液中溶質的質量分數=$\frac{溶質的質量}{溶液的質量}×100%$來分析;
(2)根據溶液稀釋過程中,溶質的質量分數不變來分析.
解答 解:(1)因為溶液中溶質的質量分數=$\frac{溶質的質量}{溶液的質量}×100%$,所以該溶液中溶質的質量分數為:$\frac{9g}{34g}×100%≈26.5%$;
(2)溶液稀釋過程中溶質的質量不變,設需加水的質量為x,則
100g×26.5%=(100g+x)×10%
x=165g
答:(1)這瓶溶液的濃度為26.5%;
(2)若將100g這瓶溶液稀釋成10%的稀溶液,需要加水的質量為165g.
點評 本題難度難度不大,考查了有關溶液的計算,掌握溶質質量分數的計算、溶質質量=溶液質量×溶質的質量分數是正確解答本題的關鍵.


科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題

查看答案和解析>>
科目:初中化學 來源: 題型:填空題
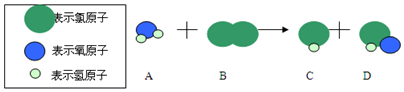
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 反應①中的H2被氧化 | B. | 反應②Cl2中的氯元素為一1價 | ||
| C. | 反應②中x為TiCl4 | D. | 反應③說明Mg的金屬活動性比Ti強 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com