
100 g某硫酸溶液恰好與13 g鋅完全起反應,試計算這種硫酸溶液中溶質的質量分數。
19.6%
【解析】考點定位分析:本題的考點是根據化學反應方程式的計算,有關溶質質量分數的簡單計算。根據化學反應方程式的計算的步驟一般分為六步:
1.設未知量,即---的質量為x;
2.書寫用到的化學方程式(即寫→配→標→注),特別是化學方程式的配平是至關重要的;
3.將用到的物質的質量關系標注在相應的化學式的正下方;上行是相對質量關系(即利用相對原子質量或相對分子質量乘以相應的化學計量數得來的),下行是純物質質量(即已知量和未知量x);
4.列計算用到比例式,即上行的相對質量比等于下行的實際質量比;
5.求算結果,注意一定要有單位;
6.寫出簡明的答案,一般是問什么就答什么。
解答過程分析:此題是溶液計算與化學方程式計算的綜合運用,硫酸溶液中的溶質就是參加了化學反應的硫酸,所以先求純硫酸質量。
設溶液中硫酸質量為x
Zn+H2SO4=ZnSO4+H2↑
65 98
13 g x
 得x=
得x=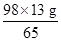 =19.6 g
=19.6 g
所以這種硫酸溶液中w(H2SO4)=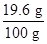 ×100%=19.6%
×100%=19.6%
試題總結評價:此題是有關化學方程式、溶質質量分數結合起來的綜合題,解題的關鍵是要弄清楚反應前的溶液中的溶質是什么,如何求該溶液中溶質質量和溶液質量。一般說來,溶質質量可利用化學方程式進行計算,再結合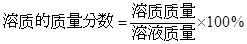 ,即可計算。
,即可計算。


 新非凡教輔沖刺100分系列答案
新非凡教輔沖刺100分系列答案科目:初中化學 來源:2008年廣東省湛江市初中畢業升學統一考試、化學試卷 題型:038
鋼鐵工業是國家工業的基礎.2007年我國粗鋼產量接近5億噸,居世界前列.湛江的東海島也將建設千萬噸鋼鐵廠,這將給湛江的經濟帶來質的飛躍.某校興趣小組取某種鋼樣進行試驗,請計算:
(1)取鋼樣(假設只含鐵單質和碳單質)粉末100 g,在氧氣中充分燃燒,得到CO2氣體4.4 g,此鋼樣粉末中碳的質量分數為________(保留到0.1%).
(2)分別向四份不同質量的鋼樣粉末中加入100 g稀硫酸溶液,充分反應后,測得的實驗數據如下表所示:
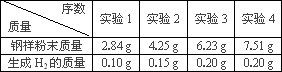
①計算硫酸溶液中溶質的質量________g
②求在實驗3中溶液的溶質質量分數?
查看答案和解析>>
科目:初中化學 來源:2010-2011學年江蘇省南京市雨花區初三第一次模擬考試化學試卷 題型:計算題
“黃銅”是銅鋅合金,具有較好機械性能,比純銅耐腐蝕,街頭許多“金色”飾品就是用它來制作的.現取20.0 g某種黃銅投入100 g某稀硫酸中,恰好完全反應后剩余的溶液和殘余固體總質量為119.8 g.請計算:
(1)產生氫氣的質量為____g.
(2)這種黃銅中銅的質量分數是多少?
(3)剩余溶液中溶質的質量分數是多少?(結果精確到0.1%)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com