
【題目】某錐形瓶盛有鹽酸和氯化銅的混合溶液100g,向其中逐滴加入溶質質量分數為10%的氫氧化鈉溶液,錐形瓶內溶液質量與滴入的氫氧化鈉溶液的質量的變化關系如圖所示。請計算:
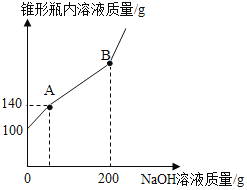
(1)A點之前都是氫氧化鈉與 _______ 反應 ;
(2)反應至A點時,消耗氫氧化鈉溶液的質量為_____g ;
(3)計算反應至B點時錐形瓶內所得溶液的溶質質量分數為_____?(計算結果保留至0.1%)
【答案】鹽酸 40g 10.4%
【解析】
(1)向混合溶液中逐滴加入氫氧化鈉溶液,根據“優先反應”原則,氫氧化鈉先與稀鹽酸反應生成氯化鈉和水,待稀鹽酸完全反應后,氫氧化鈉再與氯化銅反應生成氫氧化銅和氯化鈉,故A點之前都是氫氧化鈉與鹽酸反應;
(2)氫氧化鈉與稀鹽酸反應生成氯化鈉和水,溶液增加的質量,就是加入的氫氧化鈉的質量,反應至A點時,溶液增加40g,消耗氫氧化鈉溶液的質量為40g;
(3)解:設氫氧化鈉與鹽酸反應生成氯化鈉的質量為x

![]() x=5.85g
x=5.85g
設氫氧化鈉與氯化銅反應生成氯化鈉的質量為y,生成氫氧化銅的質量為z

![]() y=23.4g
y=23.4g
![]() z=19.6g
z=19.6g
反應至B點時錐形瓶內所得溶液的溶質質量分數為:
![]() 。
。
答:反應至B點時錐形瓶內所得溶液的溶質質量分數為10.4%。


 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源: 題型:
【題目】依據下列實驗數據和溶解度曲線回答以下小題。
① | ② | ③ | ④ | |
溫度 | 10℃ | 10℃ | 30℃ | 30℃ |
固體種類 | KNO3 | NaCl | KNO3 | NaCl |
固體質量 | 30g | 30g | 40g | 40g |
水的質量 | 100g | 100g | 100g | 100g |
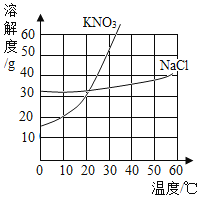
【1】①~④所得的溶液中,屬于不飽和溶液的是( )
A.①和②B.②和③C.③和④D.①和④
【2】下列說法中,正確的是( )
A.溶質質量:①=②B.溶液質量:②>③
C.溶質與溶劑質量比:①=③D.溶質質量分數:③>④
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】以空氣等為原料可合成氨、尿素[CO(NH2)2],以下是簡易生產流程的一部分。
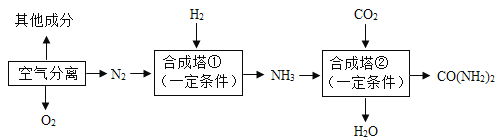
(1)工業合成氨的原料是氮氣和氫氣,氮氣可從空氣分離中獲得。此空氣分離的變化屬于_____(填“物理變化”或“化學變化”)。
(2)寫出合成塔①中合成氨的化學方程式,_____該反應的反應類型是_____。
(3)寫出合成塔②中合成尿素的化學方程式_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
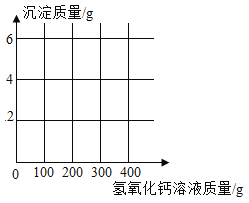
【題目】實驗室有一瓶久置的氫氧化鈉固體,李璧凝同學想了解其變質情況,稱取 9.3g 干燥的樣品,加水使其完全溶解,然后向其中逐滴滴加氫氧化鈣溶液,所得沉淀質量與加入氫氧化鈣溶液質量關系如下表所示:
實驗編號 | ① | ② | ③ | ④ |
氫氧化鈣溶液質量/g | 100 | 200 | 300 | 400 |
沉淀質量/g | 2 | m | 5 | 5 |
(1)實驗②中 m 的數值為_________________。
(2)計算該氫氧化鈉固體中碳酸鈉的質量分數____________。(寫出計算過程,結果精確到 0.1%)
(3)請在下圖中畫出生成沉淀質量隨加入氫氧化鈣溶液質量變化的曲線圖,并標出圖中的必要數據______________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下列對反應的化學方程式書寫完全正確的是( )
A.鐵絲在氧氣中燃燒:2Fe+3O2![]() 2Fe2O3
2Fe2O3
B.一氧化碳還原氧化鐵:3CO+Fe2O3═2Fe+3CO2
C.在密閉容器中燃燒紅磷驗證質量恒定律:2P+O2![]() P2O5
P2O5
D.用澄清的石灰水檢驗二氧化碳氣體:CO2+Ca(OH)2═CaCO3↓+H2O
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】鋰被譽“21世紀的能源金屬”,鋰是一種銀白色、質軟、自然界密度最小的金屬。如圖是鋰元素的原子結構示意圖及其在周期表中的相關信息。
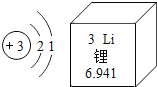
(1)鋰元素位于元素周期表中第___周期,在化學反應中容易____(填“得到”或“失去”)電子,其離子符號為______。
(2)研究表明,鋰的金屬活動性比較活潑。鋰與稀硫酸反應的化學方程式為_____,該反應的基本類型為_____。
(3)氫氧化鋰(LiOH)是一種易溶于水的白色固體,與氫氧化鈉的化學性質相似,是因為在水溶液中都能解離出_____(填“金屬”“氫”或“氫氧根”)離子。氫氧化鋰與二氧化碳反應的化學方程式為_____,在航天艙內如果要吸收航天員呼出的二氧化碳氣體,用氫氧化鋰比氫氧化鈉更理想,分析其原因是_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】甲、乙、丙三種物質的溶解度曲線如圖所示(不含結晶水),請回答:
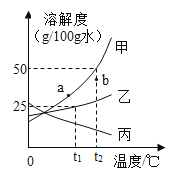
(1)0℃時,甲、乙、丙的溶解度最大的是_______。
(2)t2℃時,將30g甲固體加入到50g水中,充分攪拌后的所得溶液是_______(填“飽和”“不飽和”)。
(3)若甲中含有少量乙,應用__________法提純甲。
(4)等質量的甲、乙、丙三種飽和溶液從t2℃降溫至0℃后,溶液的質量分數由大到小的順序是______________。
(5)若使甲溶液的狀態從a點轉化為b點,可采取的措施是__________
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】分析處理圖表中的信息是學習化學的一種重要方法。運用溶解度表與溶解度曲線回答問題:
溫度/°c | 0 | 10 | 20 | 30 | 40 | 50 |
NH4C1溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
NaCl溶解度/g | 35.7 | 35.8 | 36.0 | 36,3 | 36. 6 | 37.0 |
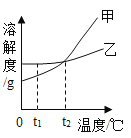
(1)氯化鈉的溶解度曲線是_____(填"甲”或“乙”)。
(2)20℃時,將40 gNH4Cl加入100 g的水中,充分攪拌后得到的是______(填“飽和”或“不飽和”)溶液。將上述溶液升溫到30 °C,該溶液的溶質質量分數為__
(3)t1 °C時,將甲、乙兩種物質的飽和溶液各100 g分別恒溫蒸發5 g水,析出晶體最多的是_____(填“甲”或'乙”)。
(4)計算配制50 g質量分數為3%的NaCl溶液所需質量分數為6%的NaCl溶液的體積,需要用到的數據是_____(填字母)。
A 3%的NaCl溶液的密度 B 水的密度 C 6%的NaCl溶液的密度
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com