
(9分)日常生活中人們廣泛使用金屬材料。
(1)下列關于金屬材料的說法正確的是 (填字母序號)。
A.鋁是人類最早利用的金屬材料
B.銅是目前世界年產量最高的金屬
C.大多數金屬元素在自然界中以單質形式存在
D.日常使用的金屬材料大多數是合金
(2)選擇鑄造硬幣的材料不需要考慮的因素是 (填字母序號)。
A. 金屬的導電性 B. 金屬的耐腐蝕性
C. 金屬的硬度 D. 金屬價格與硬幣面值的吻合度
(3)以上硬幣涉及到Fe、Cu、Al、Ni(鎳),已知Ni能夠發生如下反應:
Ni+ H2SO4= NiSO4+ H2↑ Fe+ NiCl2=" Ni" + FeCl2
這兩個反應的基本類型都是 。四種金屬活動性由強到弱的順序為 (用元素符號表示)。
(4)工業煉鐵可以把赤鐵礦(主要成分為Fe2O3 )在高爐里和CO反應,生成單質鐵,該反應的化學方程式是 ;
①氧化鐵(Fe2O3)的相對分子質量是 ;
②2000t含氧化鐵84%的赤鐵礦中理論上可煉得含鐵98%的生鐵 t。
(1)D(1分),(2)A(1分),(3)置換反應(1分),Al、Fe、Ni、Cu(1分)
(4)Fe2O3+ 3CO==== 2Fe+ 3CO2(2分) 160(1分),1200t(2分)
解析試題分析:(1)A.人類最早利用的金屬材料是銅,此項不正確。B.目前世界年產量最高的金屬是鐵,此項不正確。C.大多數金屬元素在自然界中以化合物的形式存在,此項不正確。D.日常使用的金屬材料大多數是合金。,此項正確。所以應選D項。
(2)選擇鑄造硬幣的材料不需要考慮金屬的導電性,所以應選A項。
(3)這兩個反應的基本類型都是置換反應。根據反應可知Ni的活動性大于氫,小于鐵。所以四種金屬的活動性順序為:Al、Fe、Ni、Cu。
(4)Fe2O3和CO反應,生成鐵和二氧化碳。反應的化學方程式為:Fe2O3+ 3CO高溫2Fe+ 3CO2;
①氧化鐵(Fe2O3)的相對分子質量為:56×2+16×3=160;
②可根據鐵元素的質量在冶煉過程中是守恒的,可計算出礦石中鐵元素的質量,即為生鐵中鐵元素的質量,進一步求出冶煉出生鐵的質量。具體過程為:
答:可冶煉出鐵的質量為:2000t×84%×(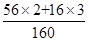 ×100%)÷98%=1200t
×100%)÷98%=1200t
考點:常見的金屬、金屬的性質、鐵的冶煉、根據化學式的計算


科目:初中化學 來源: 題型:填空題
某同學用相同的鐵釘探究鐵生銹與哪些因素有關,設計的實驗如圖。經過一周觀察:試管A和C中的鐵釘無明顯變化,試管B中的鐵釘明顯銹蝕。
(1)通過探究發現:鐵生銹是鐵與 共同存在時發生化學反應的過程。
(2)A中加入的蒸餾水要事先煮沸,其目的是 ;
(3)通過探究,請你寫出防止鐵制品生銹的一種措施 。
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
(11分)金屬在生產生活中應用廣泛。
(1)下圖是鋁的原子結構示意圖。下列說法不正確的是 。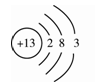
A.鋁原子的質子數為13 B.化合物中鋁元素通常顯+3價
C.鋁是地殼中含量最多的元素 D.鋁可作導線是由于它具有良好的導電性
(2)21世紀是鈦的世紀。下面是利用鈦白粉(TiO2)生產海綿鈦(Ti)的一種工藝流程: 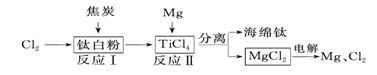
①反應Ⅰ在800~900 ℃的條件下進行,還生成一種可燃性無色氣體,該反應的化學方程式為___ __;
②反應II可獲得海錦鈦,化學方程式表示為TiCl2+2Mg 高溫Ti+2MgCl2。該反應屬于
(填序號)。
A.化合反應 B.分解反應 C.置換反應 D.復分解反應
③該工藝流程中,可循環利用的兩種物質是 、 。
(3)現有鋁、鐵、銅、銀四種金屬相互轉化關系如圖所示。 試推理乙是 ;寫出甲→丙反應的化學方程式 。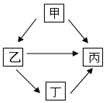
(4)向一定質量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液質量與加入Zn的質量關系如圖所示,下列說法正確的是 。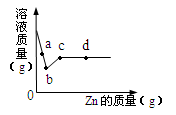
A.a點溶液中的溶質有4種
B.c點溶液中溶質為Zn(NO3)2
C.若取b~c段溶液,滴加稀鹽酸,有白色沉淀
D.取d點的固體,加入稀鹽酸,有氣泡產生
(5)相同質量的鋅、鐵分別與稀鹽酸作用,產生H2的質量m(H2)與加入稀鹽酸的體積V(稀鹽酸)關系如下圖所示,其中正確的是 。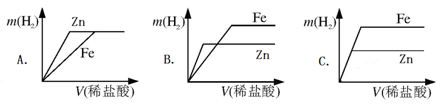
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
人類的生產生活離不開材料.(每空1分,計10分)
(1)人們習慣上把金、銀、錫、銅、鐵五種金屬統稱為“五金”,在“五金”順序中把金屬 的位置向左移一位,正好符合由弱到強的活動性順序.某金屬加入到稀硫酸中溶液變為淺綠色,則反應的化學方程式為 。
(2)為了防止水龍頭生銹,其表面常鍍一層鉻,其防銹的原理是: ,炒菜時鐵鍋中的油著火可用鍋蓋蓋滅,其原理是______________________________________。
(3)CO可作冶金工業原料,但對人體健康有害;寫出高爐煉鐵中CO還原氧化鐵的化學反應方程式: ;煤氣中毒是因為CO與血液中 結合,造成人體缺氧。
(4)現有一包銅、鋅混合粉末,在空氣中充分灼燒后,加入稀硫酸至固體恰好溶解,再加入一定量的鐵粉,充分反應后過濾,得到濾渣和濾液。則濾渣中一定有 ;濾液中溶質一定有 。
(5)家用空調常用銅線圈,這是利用銅具有優良的 性,要驗證鎂、鋁、銅的活動性順序,他選擇了打磨過的鋁絲、硫酸銅溶液,你認為他還需要的溶液是______ ______溶液。
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
(5分)金屬在生產、生活中應用廣泛。
(1)在汽車電路中,經常用銅作導線,這是利用了銅的 ;汽車車體表面噴漆不僅美觀,而且可有效防止與 接觸而生銹。
(2)鋁和氧化鐵在高溫下發生置換反應,放出大量的熱,工業上常利用此反應焊接鐵軌。該反應的化學方程式為 。
(3)向一定質量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液質量與加入Zn的質量關系如下圖所示,則a點溶液中的溶質及c點所得固體分別為 (寫化學式)。
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
(10分)金屬材料在生產生活中十分廣泛
(1)根據下圖金屬應用實例推斷,金屬具有的物理性質有 _________ (答兩點)
(2)生鐵和鋼都是鐵的合金,二者性能不同的原因是 _________ ;
(3)寫出工業上以赤鐵礦為原料煉鐵過程中,一氧化碳與氧化鐵發生反應的化學方程式 _________ ;(2分)
每年因腐蝕而消費掉的金屬材料數量驚人,鐵生銹的條件是 _________ ;防止金屬腐蝕是保護金屬資源的一條有效途徑,保護金屬資源的途徑還有 _________ (答一條即可);
(4)將一定量的鋅粉放入稀硫酸、硫酸亞鐵、硫酸銅的混合溶液中,充分反應后過濾,向濾渣中加鹽酸有氣泡產生.則濾渣中一定含有固體的化學式是 _________ ;濾液中一定不含的物質名稱是 _________ .(4分)
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
將一定量的鋅粉和鐵粉同時放入硫酸銅溶液中,充分反應后,過濾得濾渣和無色濾液。
(1)濾液中大量存在的陽離子是 (用化學用語表示);
(2)濾渣中一定有 ;
(3)請寫出一個該實驗過程中發生反應的化學方程式: ;
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
生活中處處有化學,請用所學知識回答下列問題。
(1)鋁制餐具比鐵制餐具更耐腐蝕,原因是__________________________。
(2)硝酸銨又稱“硝銨”,是一種常用氮肥,向硝酸銨溶液中加入紫色石蕊溶液,溶液變紅色,硝酸銨溶液顯__________(填“酸性”“堿性”或“中性”)。銨態氮肥遇到堿時能發生化學反應,該反應的基本反應類型是________________。
(3)食醋中含3%~5%的醋酸,生活中常用食醋清洗水垢[Mg(OH)2和CaCO3]。已知醋酸的水溶液中存在CH3COO-和H+,醋酸與CaCO3反應的化學方程式為2CH3COOH+CaCO3=(CH3COO)2Ca+H2O+CO2↑,請寫出醋酸與Mg(OH)2反應的化學方程式:___________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com