
【題目】向一定量Ba(OH)2的溶液中加入稀H2SO4溶液,與反應有關的變化關系用下圖表示,其中錯誤的是

A. A B. B C. C D. D
【答案】B
【解析】A、Ba(OH)2的溶液呈堿性,開始溶液的pH大于7,隨反應的進行氫氧化鋇逐漸減少,pH變小,剛好完全反應時pH=7;酸過量時,pH小于7.圖像正確;B、氫氧化鋇最終能被反應完,最后氫氧化鋇的質量為零,B錯誤;C、Ba(OH)2的溶液中加入稀H2SO4溶液,隨反應的進行,生成物硫酸鋇逐漸增多,氫氧化鋇被反應完,硫酸鋇的質量達到最大值,并不再改變,C正確;溶液中的導電微粒是溶液中自由的離子,反應中離子逐漸減少,所以導電性逐漸變小,剛好完全反應時只有沉淀和水,沒有離子,導電性為零,酸過量后,溶液中的又有了氫離子和硫酸根離子,并不斷增多,所以導電性又逐漸增強。D正確;選B


 口算心算速算應用題系列答案
口算心算速算應用題系列答案 同步拓展閱讀系列答案
同步拓展閱讀系列答案科目:初中化學 來源: 題型:
【題目】為探究氫氧化鈣溶液和稀鹽酸反應所得溶液中溶質的成分,小鳴和同學們通過測定了反應后溶液的pH,得到了如下圖所示的pH曲線,請回答:
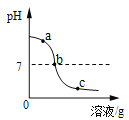
(1)由圖可知該實驗操作是將__________滴加到另一種溶液中;
(2)該反應的化學方程式為___________;
(3)實驗過程中,小鳴取了a、b、c三處反應后的溶液于三個燒杯中,卻忘了作標記,請你設計不同的方案(不再用測定pH的方法),探究三種樣品分別屬于哪處溶液。
【查閱資料】CaCl2溶液顯中性,CaCl2+Na2CO3=CaCO3↓+2NaCl。
【探究過程】
①分別取少量樣品于三支試管中,加入酚酞試液,觀察到其中一支試管內出現___________的現象。結論:該樣品是a處溶液。
②為進一步確定b或c處溶液,又設計了以下方案:
實驗步驟 | 實驗現象 | 實驗結論 |
另取余下樣品少量于兩支試管中,分別滴加足量的Na2CO3溶液。 | ________ | 該樣品為b處溶液。 |
【反思評價】探究反應后溶液中溶質的成分,除了要考慮生成物之外,還要考慮____________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】Ⅰ.質量守恒定律的發現對化學的發展做出了重要貢獻。
(1)通過稱量下列各組試劑在密閉容器內混合前后的總質量,能驗證質量守恒定律的
是____________(填數字序號)。
① 食鹽和水 ② 氯化鈉溶液和硝酸鉀溶液 ③ 鐵和氯化銅溶液
(2)某反應的微觀示意圖如下圖所示:
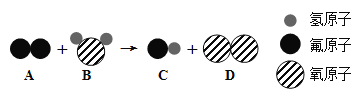
① A的化學式為_________。
② 該反應所屬的基本反應類型為___________________反應。
③ 參加反應的A物質和生成的C物質分子數目比為____________________。
Ⅱ.甲和乙兩種固態物質的飽和溶液中溶質質量分數與溫度的關系如右圖所示:
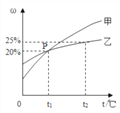
(1)甲和乙兩種物質的溶解度隨溫度的升高而___________(填“增大”或“減小”)。
(2)下列對P點的含義敘述正確的是_____________(填字母序號)。
A.t1℃時,甲和乙兩種物質的溶解度相等
B.t1℃時,甲和乙兩種物質溶液的溶質質量分數相等
C.t1℃時,甲和乙兩種物質的飽和溶液中溶質的質量相等
(3)25 g乙物質完全溶于100g水中所需的最低溫度是________℃。
(4)t2℃時,若甲和乙兩種物質的飽和溶液中析出等量的固體須蒸發掉較多水的是_________(填“甲”或“乙”)物質飽和溶液。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某興趣小組用如圖所示裝置制取氧氣,試管中固體的質量隨時間變化的數據見下表。制取結束后,將剩余固體用適量水充分溶解后,過濾,回收二氧化錳固體,并得到氯化鉀不飽和溶液100g。

加熱時間/min | 0 | t1 | t2 | t3 |
固體質量/g | 28.0 | 23.2 | 18.4 | 18.4 |
(1)共制得氧氣 g。
(2)計算所得氯化鉀溶液的溶質質量分數。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】現有30℃時的氯化鈉飽和溶液,在下列情況下溶液中溶質的質量分數不變的是
A. 溫度不變,向溶液中加入氯化鈉晶體 B. 溫度不變,向溶液中加入水
C. 升高溫度蒸發掉一部分水,溫度保持在40℃ D. 降溫至10℃
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com