解答:(1)在T
2溫度時,開始在100L的密閉容器中加入4.0molSO
2和10.0molO
2,一定條件下當反應達到平衡時共放出熱量196kJ根據1molSO
2完全反應放熱98KJ;則一定條件下當反應達到平衡時共放出熱量196kJ,消耗二氧化硫物質的量=
=2mol;依據化學平衡三段式列式計算:
SO
2(g)+
O
2(g)?SO
3(g)
開始量(mol) 4 10 0
變化量(mol) 2 1 2
平衡量(mol) 2 9 2
所以SO
2的轉化率α=
×100%=50%,故答案為:50%;
(2)A.保持溫度和容器體積不變,充入2mol SO
3,平衡向逆反應分析移動,則SO
2、O
2、SO
3氣體平衡濃度都比原來增大,故A正確;
B.保持溫度和容器體積不變,充入2mol N
2,對平衡移動沒有影響,各物質的濃度不變,故B錯誤;
C.保持溫度和容器體積不變,充入0.5mol SO
2和0.25mol O
2,平衡向正反應方向移動,則SO
2、O
2、SO
3氣體平衡濃度都比原來增大,故C正確;
D.保持溫度和容器內壓強不變,充入1mol SO
3,處于等效平衡狀態,濃度不變,故D錯誤;
E.升高溫度,平衡向逆反應分析移動,SO
3的濃度減小,故E錯誤;
F.移動活塞壓縮氣體,體積減小,各物質的濃度都增大,故F正確.
故答案為:A、C、F
(3)依據圖裝置分析,二氧化硫失電子發生氧化反應,二氧化硫被氧化為三氧化硫溶于水生成硫酸;電極反應為:SO
2+2H
2O-2e
-=SO
42-+4H
+;
故答案為:SO
2+2H
2O-2e
-=SO
42-+4H
+;取少量溶液于試管中加入鹽酸,無明顯現象,再加入BaCl
2溶液,若產生白色沉淀說明溶液中含SO
42-(4))A.升高溫度,逆反應速率增大更多,平衡向逆反應方向移動,圖象與實際符合,故A正確;
B.升高溫度,平衡向逆反應方向移動,三氧化硫的含量降低,圖象與實際符合,故B正確;
C.升高溫度,加快反應速率到達平均的時間縮短,逆反應速率增大更多,平衡向逆反應方向移動,三氧化硫的含量降低,圖象與實際不符,故C錯誤;
D.增大壓強,加快反應速率到達平均的時間縮短,正反應速率增大更多,平衡向正反應方向移動,三氧化硫的含量增大,圖象與實際符合,故D正確;
故答案為:ABD
(5)最高價元素只有氧化性,最低價元素只有還原性,中間價態的元素既有氧化性又有還原性;將SO
2氣體通入酸性KMnO
4中,酸性KMnO
4褪色,高錳酸鉀中錳元素是最高價具有氧化性,二氧化硫具有還原性;高錳酸鉀中某元素的化合價是+7價,反應后生成Mn
2+;所以一個高錳酸鉀離子被還原為錳離子轉移的電子數是5個,二氧化硫被氧化后生成硫酸根離子,硫元素的化合價由+4價變為+6價,一個二氧化硫分子生成一個硫酸根離子轉移的電子數是2個,故答案:還原性,2:5

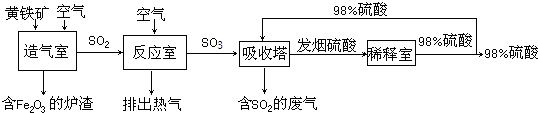
 工業制硫酸時,利用催化氧化反應將SO2轉化為SO3是一個關鍵的步驟.
工業制硫酸時,利用催化氧化反應將SO2轉化為SO3是一個關鍵的步驟.


 名校課堂系列答案
名校課堂系列答案