

 =
=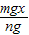 ,解得x=
,解得x=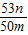 ,故答案為:
,故答案為: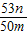 ;
;

科目:初中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
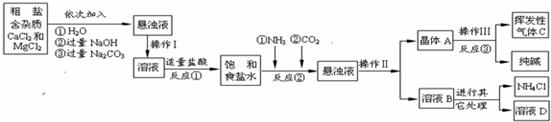
| 物質 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710g | 0.9g |
| 工業純堿標準:(Na2CO3%≥) | ||
| 優等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源:2009年黑龍江省大慶市中考化學試題 題型:058
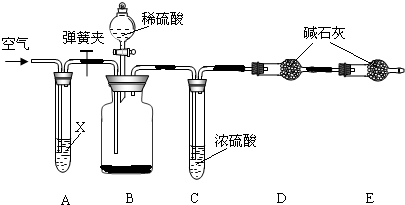
侯氏制堿法所得的純堿中常含有少量氯化鈉,現用下圖所示裝置來測定純堿樣品中碳酸鈉的質量分數(鐵架臺、鐵夾等固定裝置已略去).

實驗步驟如下:
①按圖連接裝置,并檢查氣密性;
②準確稱得盛有堿石灰(固體氫氧化鈉和氧化鈣的混合物)的干燥管D的質量為83.4 g;
③準確稱得6.0 g純堿樣品放入裝置B的廣口瓶中;
④打開裝置B的分液漏斗旋塞,緩緩滴入稀硫酸,至不再產生氣泡為止;
⑤打開彈簧夾,往試管A中緩緩鼓入空氣數分鐘,然后稱得干燥管D的總質量為85.6 g.
試回答:
(1)鼓入空氣的目的是________,裝置A中試劑X最適宜選用________.
(2)若沒有C裝置,則會導致測定結果________(填:“偏大”或“偏小”).
(3)E裝置的作用是________.
(4)請根據實驗中測得的有關數據,計算純堿樣品中碳酸鈉的質量分數.(要求:寫出計算過程,結果保留1位小數)
查看答案和解析>>
科目:初中化學 來源:黑龍江省中考真題 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com