某化驗員對本煉鐵廠購進的赤鐵礦(主要成分是Fe2O3)樣品進行分析.取10.0克樣品,加入稀鹽酸(反應的化學方程式:Fe2O3+6HCl=2FeCl2+3H2O),完全反應,共用去稀鹽酸103.0克,將濾渣過濾、洗滌、干燥后質量為2.5克,(假設雜質既不溶于酸,也不溶于水;不考慮實驗中的損耗).求(計算保留一位小數):
(1)赤鐵礦樣品中Fe2O3的質量分數為多少?
(2)稀鹽酸中溶質的質量分數為多少?
解:(1)依據題意可知,赤鐵礦中氧化鐵的質量為:10.0g-2.5g=7.5g;
赤鐵礦石樣品中的Fe
2O
3的質量分數為
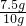
×100%=75%
(2)設反應消耗氯化氫的質量是x;
Fe
2O
3+6HCl═2FeCl
3+3 H
2O
160 219
7.5g x
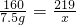
x≈10.3g
稀鹽酸的溶質質量分數
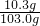
×100%=10%
答:(1)赤鐵礦樣品中Fe
2O
3的質量分數為75%;(2)稀鹽酸中溶質的質量分數為10%;
分析:(1)由題意可知赤鐵礦石中的雜質既不容易酸,也不溶于水,而且該題目中涉及的化學反應也不會生成沉淀,所以濾渣的質量就是赤鐵礦石中雜質的質量.那么樣品中Fe
2O
3的質量=用樣品的質量-雜質的質量.
(2)由氧化鐵的質量根據氧化鐵與稀鹽酸反應的化學方程式可以計算出稀鹽酸中溶質的質量分數.
點評:本題難度不大,掌握利用化學方程式與溶質質量分數的綜合計算即可正確解答本題,解題時要注意解題的規范性.

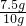 ×100%=75%
×100%=75% 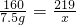
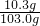 ×100%=10%
×100%=10%
