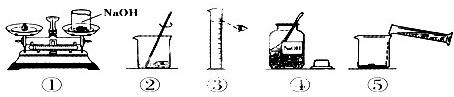
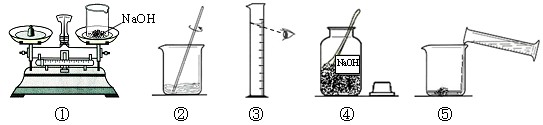
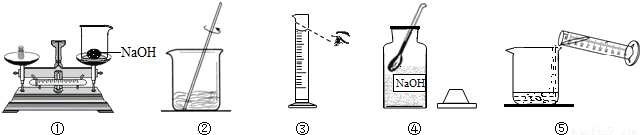
解:(1)溶質質量=溶液質量×溶質的質量分數,100g質量分數為10%的氫氧化鈉溶液,需氫氧化鈉的質量=100g×10%=10g;溶劑質量=溶液質量-溶質質量,則所需蒸餾水的質量=100g-10g=90g
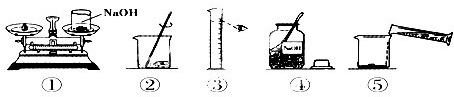
(2)水的密度為1g/cm
3,則根據V=
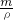
=
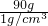
=90cm
3=90mL,應選用100mL的量筒.
(3)托盤天平的使用要遵循“左物右碼”的原則,圖①中氫氧化鈉與砝碼的位置顛倒.
量取液體時,視線與液體的凹液面最低處保持水平,圖中仰視刻度,操作錯誤.
(4)配制100g質量分數為10%的氫氧化鈉溶液的步驟:計算、稱量(量取)、溶解、裝瓶貼簽,用圖示的序號表示為:④①③⑤②.
(5)設要加水的質量為x,根據溶液稀釋前后,溶質的質量不變,
則100g×10%=(100g+x)×8% x=g.
故答案為:(1)10;90;(2)100;(3)圖①中氫氧化鈉與砝碼的位置顛倒等;(4)④①③⑤②;(5)12.5.
分析:(1)利用溶質質量=溶液質量×溶質的質量分數,可根據溶液的質量和溶質的質量分數計算配制溶液所需要的溶質的質量;再根據溶劑質量=溶液質量-溶質質量即可求得蒸餾水的質量.
(2)根據所量取水的體積確定所用量筒的量程.
(3)根據托盤天平的使用要遵循“左物右碼”的原則、量筒讀數時視線要與凹液面的最低處保持水平進行分析解答.
(4)根據配制溶質質量分數一定的溶液的基本步驟進行分析解答.
(5)根據溶液稀釋前后,溶質的質量不變,結合題意進行分析解答.
點評:本題難度不大,明確配制一定溶質質量分數的溶液實驗步驟、溶液稀釋前后溶質的質量不變等是正確解答本題的關鍵.

 =
=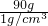 =90cm3=90mL,應選用100mL的量筒.
=90cm3=90mL,應選用100mL的量筒.

 閱讀快車系列答案
閱讀快車系列答案