樂平境內石灰石分布很廣,樂平石灰品位高,易開采,故樂平燒制石灰的歷史悠久,所產優質石灰市場廣闊.為測定某石灰石樣品中碳酸鈣的含量,取10.0克于燒杯中再向其中加入稀鹽酸50.0克,恰好完全反應(雜質不反應),反應后燒杯中物質總質量為56.7克.
(1)生成CO2的質量______.
(2)求石灰石樣品中碳酸鈣的質量分數(寫出計算過程).
【答案】
分析:(1)根據質量守恒定律可知質量的減少量就是生成二氧化碳的質量;(2)根據二氧化碳的質量算出碳酸鈣的質量,再除以樣品質量即可.
解答:解:(1)生成二氧化碳質量=10.0克+50.0克-56.7克═3.3克
(2)解:設樣品中碳酸鈣的質量為x
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑
100 44
X 3.3克

,x=7.5g
樣品中碳酸鈣的質量分數:
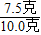
×100%=75%
答:石灰石樣品中碳酸鈣的質量分數75%.
故答案為:(1)3.3克;(2)75%.
點評:解答本題的關鍵是根據質量守恒定律可知質量的減少量就是生成二氧化碳的質量,根據二氧化碳的質量再計算碳酸鈣的質量即可.

 ,x=7.5g
,x=7.5g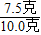 ×100%=75%
×100%=75%

 浙江名校名師金卷系列答案
浙江名校名師金卷系列答案