
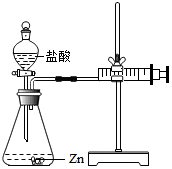
 化學興趣小組的同學對“影響金屬與鹽酸反應的劇烈程度的因素”進行了探究.
化學興趣小組的同學對“影響金屬與鹽酸反應的劇烈程度的因素”進行了探究.| 實驗 編號 | 選用金屬 (均取2g) | 鹽酸濃度 (均取50 mL) | 每30秒產生氣體的體積/mL | |||||
| 30秒 | 30~ 60秒 | 60~ 90秒 | 90~ 120秒 | 120~ 150秒 | 前150秒收 集氣體 | |||
| Ⅰ | 鋅片 | 10% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 鋅片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
分析 【設計探究】金屬與酸的反應為置換反應,寫出反應的化學方程式;根據現象得出結論;
得出結論:根據金屬的活動性順序,分析金屬的活動性與反應的劇烈程度的關系;
實驗(2)根據注射器的作用是量取生成氣體的體積解答;
得出結論:根據表中信息結合濃度對反應的影響分析解答;
【反思評價】根據表中信反應的劇烈程度與酸的濃度有關,結合反應的過程進行分析;根據控制變量法結合影響反應速率的因素進行設計實驗;
解答 解:【設計探究】由題意知:反應物、生成物,根據質量守恒定律,正確書寫化學方程式,鎂與鹽酸反應的化學方程式為:Mg+2HCl=MgCl2+H2↑;放鎂片的試管中立即產生大量氣泡,放鐵片的試管中只產生少量氣泡,因此金屬活動性強弱為:Mg>Fe;
得出結論:金屬與鹽酸反應的劇烈程度與金屬本身性質有關(金屬活動性越強,反應越劇烈);
實驗(2)注射器的作用是通過注射器往右移動的體積判斷生成氫氣的體積;
得出結論:根據表格信息可知,其他條件相同時,鹽酸濃度越大,反應越劇烈;
【反思評價】鋅與鹽酸反應產生氣體的速度先加快后變慢,因為鋅與鹽酸是放熱反應,所以開始時溫度升高,產生氣體速度加快,隨著反應的進程,鹽酸不斷被消耗,濃度降低,產生氣體速度變慢.
金屬與鹽酸反應的劇烈程度可能受固體的表面積、反應物的狀態、催化劑的影響;
故答案為:【設計探究】Mg+2HCl═MgCl2+H2↑;>;
金屬與鹽酸反應的劇烈程度與金屬本身性質有關(金屬活動性越強,反應越劇烈);
實驗(2)通過注射器往右移動的體積判斷生成氫氣的體積;
得出結論:其他條件相同時,鹽酸濃度越大,反應越劇烈;
【反思評價】由慢到快然后逐漸減慢;鋅與稀鹽酸反應放熱,隨著反應的進行,溫度升高,所以速度越來越快,一段時間后,鹽酸被消耗,鹽酸濃度變小,反應速率減慢.溫度;金屬表面積大小.
點評 本考點主要考查了影響金屬與酸發生化學反應速率的因素的探究,還考查了在生產、生活及實驗中應注意的問題.從酸的濃度、金屬的活動性和金屬的狀態等不同的角度,設計實驗,也考查了學生的實驗設計能力.要認真分析,綜合把握,問題就會迎刃而解.本考點主要出現在實驗題中.


 寒假樂園北京教育出版社系列答案
寒假樂園北京教育出版社系列答案科目:初中化學 來源: 題型:實驗探究題
 為測定空氣里氧氣的含量,甲、乙、三個同學用如圖所示的裝置分別進行了實驗探究.
為測定空氣里氧氣的含量,甲、乙、三個同學用如圖所示的裝置分別進行了實驗探究.查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
 在學校的元旦聯歡會上,某同學表演了‘水能生火’的魔術.他向包有過氧化鈉(Na2O2)粉末的脫脂棉上滴水,脫脂棉燃燒起來.小穎看到后非常感興趣,她和同學們一起對該問題進行了一系列的探究.
在學校的元旦聯歡會上,某同學表演了‘水能生火’的魔術.他向包有過氧化鈉(Na2O2)粉末的脫脂棉上滴水,脫脂棉燃燒起來.小穎看到后非常感興趣,她和同學們一起對該問題進行了一系列的探究.查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
 如圖是密閉體系中某反應的微觀示意圖,“●”和“○”分別表示兩種不同元素的原子,下列說法錯誤的是( )
如圖是密閉體系中某反應的微觀示意圖,“●”和“○”分別表示兩種不同元素的原子,下列說法錯誤的是( )| A. | 反應中,反應物分子發生了變化 | B. | 反應前后原子種類沒有改變 | ||
| C. | 反應后該密閉體系中沒有單質存在 | D. | 該反應是化合反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com