
普通食鹽的主要成份是NaCl和雜質,假設雜質不溶于水、受熱不分解、與AgNO3不反應。王華同學測定普通食鹽樣品中氯化鈉的質量分數時所進行的實驗操作流程和實驗數據如下圖所示。
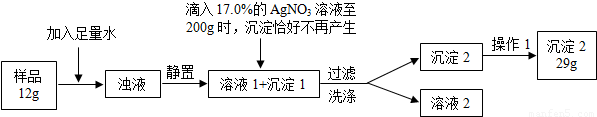
(實驗中發生的化學反應方程式為:AgNO3+NaCl=AgCl↓+NaNO3)
請你完成空格和計算:
(1)王華進行操作1的目的是 _;
(2)求算樣品中氯化鈉的質量分數。(結果保留小數點后1位)
(1)干燥沉淀2;(2)樣品中氯化鈉的質量分數為97.5%
【解析】
試題分析:(1)過濾后沉淀2表面含有水,要得到沉淀2需除去表面的水,故操作1是將沉淀2進行干燥,除去水分,所起的作用是干燥沉淀2。
(2)由題意,食鹽的主要成份是NaCl,氯化鈉與加入的硝酸銀溶液反應生成氯化銀沉淀和硝酸鈉,由參加反應的硝酸銀溶液的質量200g、溶質的質量分數17.0%,利用溶質質量=溶液質量×溶質的質量分數,計算出所含溶質硝酸銀的質量,進而由反應的化學方程式計算出樣品中氯化鈉的質量及質量分數200g17.0%的硝酸銀溶液中含硝酸銀的質量為200g×17.0%=34.0g,由于29g不溶性物質并不都是氯化銀,所以不能用于求算氯化鈉。設樣品中氯化鈉的質量為x
AgNO3+NaCl=AgCl↓+NaNO3
170 58.5
34.0g x
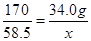
解得x=11.7g
樣品中氯化鈉的質量分數為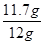 ×100%≈97.5%。
×100%≈97.5%。
答:(1)干燥沉淀2;(2)樣品中氯化鈉的質量分數為97.5%
考點:考查根據化學反應方程式的計算


 三新快車金牌周周練系列答案
三新快車金牌周周練系列答案科目:初中化學 來源: 題型:

查看答案和解析>>
科目:初中化學 來源:2013屆江蘇省南通市海安縣九年級學業水平測試(一模)化學試卷(帶解析) 題型:計算題
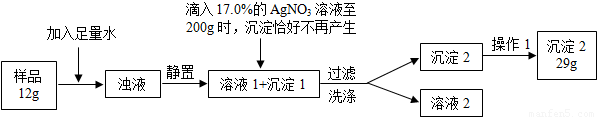
普通食鹽的主要成份是NaCl和雜質,假設雜質不溶于水、受熱不分解、與AgNO3不反應。王華同學測定普通食鹽樣品中氯化鈉的質量分數時所進行的實驗操作流程和實驗數據如下圖所示。
(實驗中發生的化學反應方程式為:AgNO3 + NaCl =" AgCl↓+" NaNO3)
請你完成空格和計算:
⑴王華進行操作1的目的是 _;
⑵求算樣品中氯化鈉的質量分數。(結果保留小數點后1位)
查看答案和解析>>
科目:初中化學 來源: 題型:
普通食鹽的主要成份是NaCl和雜質,假設雜質不溶于水、受熱不分解、與AgNO3不反應。王華同學測定普通食鹽樣品中氯化鈉的質量分數時所進行的實驗操作流程和實驗數據如下圖所示。
(實驗中發生的化學反應方程式為:AgNO3 + NaCl = AgCl↓+ NaNO3)
請你完成空格和計算:
⑴王華進行操作1的目的是 ▲ _;
⑵求算樣品中氯化 鈉的質量分數。(結果保留小數點后1位)
鈉的質量分數。(結果保留小數點后1位)
查看答案和解析>>
科目:初中化學 來源:2013年江蘇省南通市海安縣中考化學一模試卷(解析版) 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com