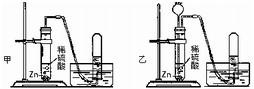
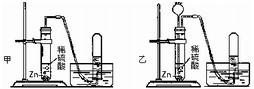
解:(1)等質量的鎂、鋁完全反應,可根據計算得知,產生氫氣的質量鋁大于鎂,所以選擇金屬時應選擇鋁;而稀鹽酸與稀硫酸相比,10%的稀鹽酸比10%的稀硫酸所含H
+濃度要大,即等量的稀鹽酸可產生更多的氫氣;綜上所述,要使小車行程最遠,應選擇②⑤,并使藥品恰好完全反應,讓效率達最大化;根據反應的化學方程式,可計算鋁與稀鹽酸恰好完全反應的質量比為:
(27×2):
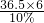
=9:365;
故答:②⑤;恰好完全反應(或鋁粉與稀鹽酸l的質量比為9:365);2Al+6HCl=2AlCl
3+3H
2↑;
(2)要使小車比(1)的運動速度快,選擇比鋁活潑的金屬鎂進行反應,同時用到酸的氫離子的濃度,放出氫氣速度更快;所以應該是選①④.
故答:①④;鎂比鋁活潑,產生氫氣速度快;
(3)不發生反應而釋放出氣體,可考慮固體物質的升華氣化如干冰等或極易揮發的物質如汽水等;
故答:干冰(或汽水);
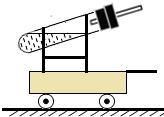
(4)在現有條件不變的情況下,使小車跑得更遠,就應使小車獲得更大的推力.可把導管彎曲成與小車運動方向水平,使力集中于推動小車;或使氫氣燃燒面發生爆炸,使氣體體積迅速膨脹而獲得更大的推動力.
故答:使小車獲得更大的推力;
改進的方法:將橡皮塞上導管的出口換成與道路水平;理由:這樣使小車受到的推進力最大
改進的方法:點燃產生的氫氣;理由:氫氣燃燒時會產生反作用力.
分析:(1)小車在同一條水平道路上行程最遠,小車是在氣體放出時產生的推力作用下前進,行程遠近與產生氣體多少成正比,產生氣體最多的小車行程最遠;
(2)小車運動的快慢決定于放出氫氣的速度,產生氫氣速度越快小車的運動速度越快,因此要使小車的運動速度比(1)中所選試劑時快,就應選擇金屬活動性(1)中金屬更活動的金屬;
(3)小車的運動是由于試管內氣體沖出時產生的推力,因此,要使小車運動,只要能使試管內釋放出氣體即可;
(4)不改變提供的試劑、不改變試劑總質量及小車、道路的條件下,從理論上講,使小車跑的更遠就應使小車獲得更大的推力.改進的方向就是使推力最大化.
點評:等量的Al、Mg、Fe、Zn金屬與足量酸完全反應,放出氫氣的量由多到少的順序為:Al>Mg>Fe>Zn.

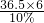 =9:365;
=9:365;

 永乾教育寒假作業快樂假期延邊人民出版社系列答案
永乾教育寒假作業快樂假期延邊人民出版社系列答案