
 時,F(xiàn)eO和C恰好完全反應(yīng)生成Fe和CO2.所以分析可得:當(dāng)
時,F(xiàn)eO和C恰好完全反應(yīng)生成Fe和CO2.所以分析可得:當(dāng) <n<1時,生成的氣體是CO2和CO,固體是Fe;當(dāng)n>1時,生成的氣體是CO,固體是C和Fe;當(dāng)n<
<n<1時,生成的氣體是CO2和CO,固體是Fe;當(dāng)n>1時,生成的氣體是CO,固體是C和Fe;當(dāng)n< 時,生成的氣體是CO2,固體是FeO和Fe.
時,生成的氣體是CO2,固體是FeO和Fe. 時,反應(yīng)器中的固體是FeO和Fe,氣體是CO2;
時,反應(yīng)器中的固體是FeO和Fe,氣體是CO2; 時,F(xiàn)eO和C恰好完全反應(yīng)生成CO2.所以若反應(yīng)的氣體產(chǎn)物是混合物,n的取值范圍是
時,F(xiàn)eO和C恰好完全反應(yīng)生成CO2.所以若反應(yīng)的氣體產(chǎn)物是混合物,n的取值范圍是 <n<1;
<n<1;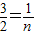 n=
n=
 2CO;(2)FeO和Fe,CO2; (3)C和Fe,CO; (4)
2CO;(2)FeO和Fe,CO2; (3)C和Fe,CO; (4) <n<1; (5)
<n<1; (5)


科目:初中化學(xué) 來源: 題型:
| 1 | 4 |
查看答案和解析>>
科目:初中化學(xué) 來源: 題型:解答題
 ,充分反應(yīng)后,反應(yīng)器中固體物質(zhì)是______,氣體產(chǎn)生是______.
,充分反應(yīng)后,反應(yīng)器中固體物質(zhì)是______,氣體產(chǎn)生是______.查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com