
| A. | 實驗剩余的藥品應放回原試劑瓶 | B. | 若取無腐蝕性藥品可直接用手拿 | ||
| C. | 取用塊狀藥品應用藥匙 | D. | 取用少量液體用膠頭滴管 |
科目:初中化學 來源: 題型:推斷題
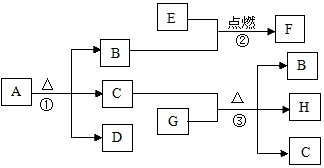 A-H是我們學過的一些物質,其中A和D組成元素相同,B是人體生命活動離不開的氣體,E是密度最小的氣體,G是白色固體.它們之間有如圖所示的轉化關系,回答下列問題:
A-H是我們學過的一些物質,其中A和D組成元素相同,B是人體生命活動離不開的氣體,E是密度最小的氣體,G是白色固體.它們之間有如圖所示的轉化關系,回答下列問題:查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
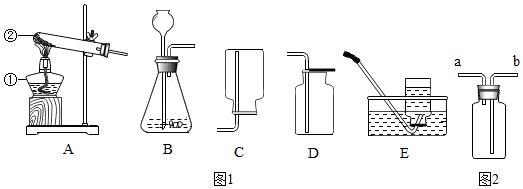
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
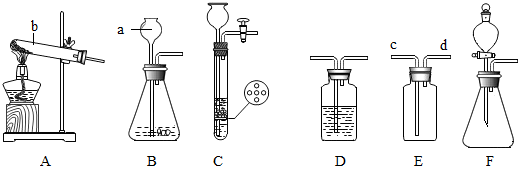
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
 化學與生活有著密切的關系,化學使我們的生活更加的美好.
化學與生活有著密切的關系,化學使我們的生活更加的美好.查看答案和解析>>
科目:初中化學 來源: 題型:解答題
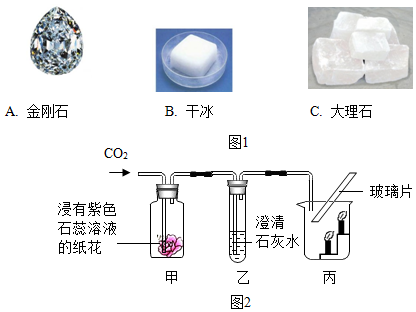
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com