

 、
、 、
、 分別表示N2、H2、NH3.在催化劑表面(下圖中
分別表示N2、H2、NH3.在催化劑表面(下圖中 表示催化劑表面)N2和H2反應合成氨的反應過程可用五張圖表示如下:
表示催化劑表面)N2和H2反應合成氨的反應過程可用五張圖表示如下:

 ×100%=14g.
×100%=14g. ×100%)=3.08g;
×100%)=3.08g; ×100%=18.1%,所以該奶粉包裝袋上所注蛋白質的含量不真實;
×100%=18.1%,所以該奶粉包裝袋上所注蛋白質的含量不真實; ×100%)=3.08g;
×100%)=3.08g; ×100%=18.1%,所以該奶粉包裝袋上所注蛋白質的含量不真實.
×100%=18.1%,所以該奶粉包裝袋上所注蛋白質的含量不真實.

科目:初中化學 來源: 題型:
 、
、 、
、 分別表示N2、H2、NH3.觀察下圖,寫出符合在催化劑表面合成氨反應過程的順序
分別表示N2、H2、NH3.觀察下圖,寫出符合在催化劑表面合成氨反應過程的順序
查看答案和解析>>
科目:初中化學 來源: 題型:
 分別表示N2、H2、NH3.觀察下圖,寫出符合在催化劑表面
分別表示N2、H2、NH3.觀察下圖,寫出符合在催化劑表面
查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
 、
、 、
、 分別表示N2、H2、NH3.在催化劑表面(
分別表示N2、H2、NH3.在催化劑表面( 下圖中表示催化劑表面)N2和H2反應合成氨的反應過程可用五張圖表示如下:
下圖中表示催化劑表面)N2和H2反應合成氨的反應過程可用五張圖表示如下:
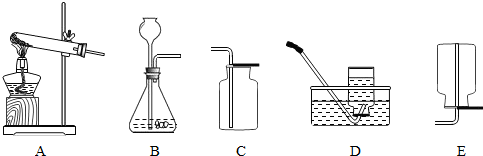
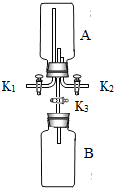 微粒的基本性質”的實驗探究,實驗過程如下:
微粒的基本性質”的實驗探究,實驗過程如下:查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
 、
、 、
、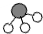 分別表示N2、H2、NH3.在催化劑表面(下圖中
分別表示N2、H2、NH3.在催化劑表面(下圖中 表示催化劑表面)N2和H2反應合成氨的反應過程可用五張圖表示如下:
表示催化劑表面)N2和H2反應合成氨的反應過程可用五張圖表示如下:

查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com