
 已知甲、乙分別是稀硫酸和氫氧化鈉溶液中的一種.某化學興趣小組的同學在探究甲和乙溶液進行中和反應時,測得反應過程中溶液酸堿度變化及相關數據如圖所示.試根據要求,回答下列問題:
已知甲、乙分別是稀硫酸和氫氧化鈉溶液中的一種.某化學興趣小組的同學在探究甲和乙溶液進行中和反應時,測得反應過程中溶液酸堿度變化及相關數據如圖所示.試根據要求,回答下列問題: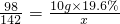 解得:X=3.04
解得:X=3.04

 一線名師提優試卷系列答案
一線名師提優試卷系列答案 陽光試卷單元測試卷系列答案
陽光試卷單元測試卷系列答案科目:初中化學 來源: 題型:
 23、如圖表示:向盛有10mL稀的甲溶液(其中滴有少量紫色石蕊試劑)中,加入乙溶液時,溶液pH的變化曲線.已知甲、乙分別是鹽酸溶液和氫氧化鈉溶液中的一種.請分析曲線回答問題:
23、如圖表示:向盛有10mL稀的甲溶液(其中滴有少量紫色石蕊試劑)中,加入乙溶液時,溶液pH的變化曲線.已知甲、乙分別是鹽酸溶液和氫氧化鈉溶液中的一種.請分析曲線回答問題:查看答案和解析>>
科目:初中化學 來源: 題型:
 已知甲、乙分別是稀硫酸和氫氧化鈉溶液中的一種.某化學興趣小組的同學在探究甲和乙溶液進行中和反應時,測得反應過程中溶液酸堿度變化及相關數據如圖所示.試根據要求,回答下列問題:
已知甲、乙分別是稀硫酸和氫氧化鈉溶液中的一種.某化學興趣小組的同學在探究甲和乙溶液進行中和反應時,測得反應過程中溶液酸堿度變化及相關數據如圖所示.試根據要求,回答下列問題:查看答案和解析>>
科目:初中化學 來源: 題型:
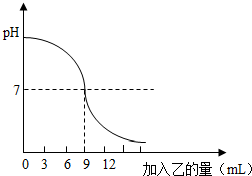 如圖表示:向盛有lOmL稀的甲溶液(其中滴有少量紫色石蕊試劑)中,加入乙溶液時,溶液pH的變化曲線.已知甲、乙分別是鹽酸溶液和氫氧化鈉溶液中的一種.請分析曲線回答問題:
如圖表示:向盛有lOmL稀的甲溶液(其中滴有少量紫色石蕊試劑)中,加入乙溶液時,溶液pH的變化曲線.已知甲、乙分別是鹽酸溶液和氫氧化鈉溶液中的一種.請分析曲線回答問題:查看答案和解析>>
科目:初中化學 來源:2011-2012學年山東省濟南市歷下區九年級(上)發展性能力測試化學試卷(解析版) 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com