

 2H2O;氫氣作為燃料的優點有:燃燒放熱多,能用水分解制得,可再生,產物是不污染環境的水;
2H2O;氫氣作為燃料的優點有:燃燒放熱多,能用水分解制得,可再生,產物是不污染環境的水; 2H2O、無污染(2)12(3)①+4②2Mg+TiCl4
2H2O、無污染(2)12(3)①+4②2Mg+TiCl4 2MgCl2+Ti、置換反應
2MgCl2+Ti、置換反應

科目:初中化學 來源: 題型:閱讀理解
 “嫦娥一號”的成功發射,使全國人民歡欣鼓舞.請同學們閱讀下列航天技術中的化學短文并回答有關問題.
“嫦娥一號”的成功發射,使全國人民歡欣鼓舞.請同學們閱讀下列航天技術中的化學短文并回答有關問題.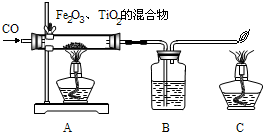
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
 (2013?江西模擬)“嫦娥一號”的成功發射,使全國人民歡欣鼓舞.請同學們閱讀下列航天技術中的化學短文并回答有關問題.
(2013?江西模擬)“嫦娥一號”的成功發射,使全國人民歡欣鼓舞.請同學們閱讀下列航天技術中的化學短文并回答有關問題.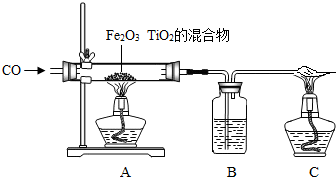
| ||
| ||
| ||
| ||
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com