
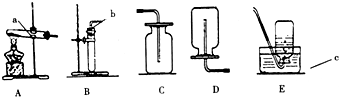
 實驗室制取氧氣,可供選擇的實驗裝置如圖所示:
實驗室制取氧氣,可供選擇的實驗裝置如圖所示:分析 (1)根據高錳酸鉀加熱制取氧氣的原理、注意事項,及氧氣的密度和溶解性分析解答;
(2)根據用過氧化氫溶液和二氧化錳制取氧氣的反應物的狀態及反應條件確定發生裝置,加入藥品之前要檢查裝置的氣密性,防止裝置漏氣;裝置氣密性檢驗的原理是:通過氣體發生器與液體構成封閉體系,依據改變體系內壓強時產生的現象(如氣泡的生成、水柱的形成、液面的升降等)來判斷裝置氣密性的好壞;
(3)若收集一瓶供鐵絲在氧氣中燃燒的實驗使用的氧氣,由于在集氣瓶的底部須加少量的水,最好用排水法收集.
(4)高錳酸鉀受熱分解后生成錳酸鉀、二氧化錳和氧氣,由于氧氣逸出,所以反應后固體質量會減少;根據質量守恒定律可知,固體質量的減少量即為生成氧氣的質量,然后根據反應方程式由氧氣的質量求出參加反應的高錳酸鉀及剩余的高錳酸鉀和二氧化錳的質量.
解答 解:(1)若用高錳酸鉀加熱制取氧氣,同時生成錳酸鉀和二氧化錳,圖中的錯誤是:試管口沒塞棉花,不能防止高錳酸鉀粉末進入導管;氧氣密度比空氣大且不易溶于水,所以可用向上排空氣法或排水法收集;故填:C(或E);
(2)若用過氧化氫溶液和二氧化錳制取氧氣,可認為是固體和液體常溫下反應,應選用發生裝置是B,在加試劑之前的操作是檢查裝置的氣密性.檢查實驗室制氧氣裝置的裝置氣密性的方法是把導管的一端浸沒在水里,雙手緊貼試管外壁,若導管口有氣泡冒出,說明裝置不漏氣;
(3)若收集一瓶氧氣,供鐵絲在氧氣中燃燒的實驗使用,最好選用排水法收集,氣體的收集裝置最好用E,因為做此實驗時集氣瓶底部要留少量水;鐵絲在氧氣中劇烈燃燒,火星四射,放出大量的熱,生成一種黑色固體.
(4)①由質量守恒定律可知,生成氧氣的質量是:10g-9.36g=0.64g;
②設參加反應的KMnO4質量為x,
2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4 +MnO2 +O2↑
316 32
x 0.64g
則$\frac{316}{32}=\frac{x}{0.64g}$,解得:x=6.32g
剩余固體中未反應高錳酸鉀的質量為:10g-6.32g=3.68g.
故答案為:
(1)在試管口放一團棉花,CE;
(2)B,檢查裝置的氣密性,把導管的一端浸沒在水里,雙手緊貼試管外壁,若導管口有氣泡冒出,說明裝置不漏氣.
(3)E,劇烈燃燒,火星四射,放出大量的熱,生成一種黑色固體.
(4)0.64g;3.68g.
點評 本道題主要考查了實驗室制取氣體發生裝置和收集裝置的選擇,發生裝置主要取決于反應物的狀態和反應條件,收集裝置主要取決于氣體的密度、溶水性,牢記相關知識是解答的基礎和關鍵.


科目:初中化學 來源: 題型:填空題
 用有關水的知識,回答下列問題.
用有關水的知識,回答下列問題.查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com