
 氯化鈉除了用做調味品外,還是一種重要的化工原料.氯堿廠用給氯化鈉溶液通電的方法可制得氫氧化鈉、氯氣和氫氣.某實驗小組同學在老師幫助下,取一定質量含氯化鈉質量分數為10%的溶液進行電解,當氯化鈉完全反應后,停止通電.下圖是他們對生成的氯氣質量與時間關系所做的分析記錄.試計算:
氯化鈉除了用做調味品外,還是一種重要的化工原料.氯堿廠用給氯化鈉溶液通電的方法可制得氫氧化鈉、氯氣和氫氣.某實驗小組同學在老師幫助下,取一定質量含氯化鈉質量分數為10%的溶液進行電解,當氯化鈉完全反應后,停止通電.下圖是他們對生成的氯氣質量與時間關系所做的分析記錄.試計算: Cl2↑+H2↑+2NaOH;
Cl2↑+H2↑+2NaOH; Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH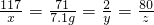
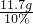 ═117g
═117g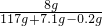 ×100%≈7.3%
×100%≈7.3%

科目:初中化學 來源: 題型:
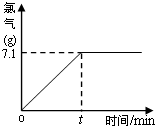 (2009?通州區一模)氯化鈉除了用做調味品外,還是一種重要的化工原料.氯堿廠用給氯化鈉溶液通電的方法可制得氫氧化鈉、氯氣和氫氣.某實驗小組同學在老師幫助下,取一定質量含氯化鈉質量分數為10%的溶液進行電解,當氯化鈉完全反應后,停止通電.下圖是他們對生成的氯氣質量與時間關系所做的分析記錄.試計算:
(2009?通州區一模)氯化鈉除了用做調味品外,還是一種重要的化工原料.氯堿廠用給氯化鈉溶液通電的方法可制得氫氧化鈉、氯氣和氫氣.某實驗小組同學在老師幫助下,取一定質量含氯化鈉質量分數為10%的溶液進行電解,當氯化鈉完全反應后,停止通電.下圖是他們對生成的氯氣質量與時間關系所做的分析記錄.試計算:查看答案和解析>>
科目:初中化學 來源:2009年北京市通州區中考化學一模試卷(解析版) 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com