
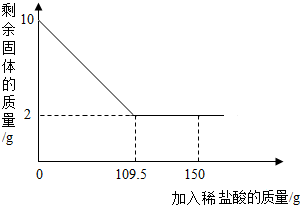
 有一赤鐵礦樣品(主要成分為Fe2O3),某學校化學興趣小組為了測得樣品中氧化鐵的質量分數,進行了如下探究:小明取10g赤鐵礦樣品(雜質不溶于水和酸),不斷加入稀鹽酸到固體的質量不再減少,加入稀鹽酸的量如圖所示:求:
有一赤鐵礦樣品(主要成分為Fe2O3),某學校化學興趣小組為了測得樣品中氧化鐵的質量分數,進行了如下探究:小明取10g赤鐵礦樣品(雜質不溶于水和酸),不斷加入稀鹽酸到固體的質量不再減少,加入稀鹽酸的量如圖所示:求:分析 根據圖可知,10g樣品中雜質的質量為2g,則氧化鐵的質量為8g,可求赤鐵礦中氧化鐵的質量分數.根據8g氧化鐵和109.5g鹽酸結合對應的化學方程式求算稀鹽酸中溶質的質量,進而求算其質量分數.
解答 解:
(1)根據固體最后剩余2g可知,雜質的質量為2g,則氧化鐵的質量為8g
赤鐵礦中氧化鐵的質量分數為$\frac{8g}{10g}$×100%=80%;
(2)設參加反應的鹽酸的質量為x
Fe2O3+6HCl=2FeCl3+3H2O
160 219
8g x
$\frac{160}{219}$=$\frac{8g}{x}$
x=10.95g
所以所使用的稀鹽酸的溶質質量分數為:$\frac{10.95g}{109.5g}$×100%=10%
答:(1)赤鐵礦中氧化鐵的質量分數是 80%;
(2)所使用的稀鹽酸的溶質質量分數為10%.
點評 根據化學方程式計算時,第一要正確書寫化學方程式,第二要使用正確的數據,第三計算過程要完整.


 一本好題口算題卡系列答案
一本好題口算題卡系列答案科目:初中化學 來源: 題型:填空題
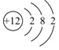 ,鎂元素位于周期表中第三周期.;
,鎂元素位于周期表中第三周期.;查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 有Zn | B. | 有ZnCuAg | C. | 有Cu和Ag | D. | 有Ag |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | ②④ | B. | ④⑥ | C. | ①②④ | D. | ②③⑤ |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
 2008年“中國水周”活動的宣傳主題為“發展水利,改善民生”.
2008年“中國水周”活動的宣傳主題為“發展水利,改善民生”.| 實驗步驟 | 實驗現象 | 結論或化學方程式 |
| ①取少量水樣于試管中,滴加氫氧化鈣溶液,直到不再產生沉淀 | 有白色沉淀產生 | MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2 |
| ②繼續向上述試管中滴加 飽和Na2CO3溶液直到不再產生沉淀 | 有白色沉淀產生 | Na2CO3+CaCl2═CaCO3↓+2NaCl |
| ③過濾 | 濾液澄清 | --- |
| ④向濾液中滴加適量的肥皂水 | 產生大量泡沫 | 證明硬水已軟化 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
 A-F是初中化學中常見的六種物質,其中B、C組成元素相同,C、D、E、F是不同類別的化合物,D和E的溶液均呈堿性,且E可用作農業上改良酸性土壤,它們相互間的關系如圖所示,(圖中“-”表示相連的物質兩兩之間可以發生反應,“→”表示由某一物質轉化為另一物質,部分反應物、生成物及反應條件已略去),請回答:
A-F是初中化學中常見的六種物質,其中B、C組成元素相同,C、D、E、F是不同類別的化合物,D和E的溶液均呈堿性,且E可用作農業上改良酸性土壤,它們相互間的關系如圖所示,(圖中“-”表示相連的物質兩兩之間可以發生反應,“→”表示由某一物質轉化為另一物質,部分反應物、生成物及反應條件已略去),請回答:查看答案和解析>>
科目:初中化學 來源: 題型:選擇題

| A. | 反應生成的丙、丁物質的質量比為22:9 | |
| B. | 乙、丙、丁均為氧化物 | |
| C. | 參加反應的甲、乙分子個數比為1:1 | |
| D. | 該反應屬于置換反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com