
【題目】菱鐵礦(主要成分是FeCO3)是煉鐵的原料。現取20.0g菱鐵礦,向其中加入足量稀硫酸,充分反應,測得固體質量與所加稀硫酸的質量關系如下圖所示。

已知:①FeCO3+H2SO4=FeSO4+CO2↑+H2O
②菱鐵礦中雜質不參加反應,且難溶于水。
請計算:
(1)20.0g菱鐵礦中FeCO3的質量為 g。
(2)列式計算所用稀硫酸的溶質質量分數(結果準確到0。1%)
【答案】(1)11.6 (2)19.6%
【解析】
試題分析:(1)根據圖示,當反應結束剩余的固體質量即為菱鐵礦中不參加反應,且難溶于水的雜質,故20.0g菱鐵礦中FeCO3的質量=20.0g-8.4g=11.6g
(2)根據化學方程式:FeCO3+H2SO4=FeSO4+CO2↑+H2O中FeCO3與H2SO4的質量關系,可計算出H2SO4的質量,進一步計算所用稀硫酸的溶質質量分數
解:設H2SO4的質量為x
FeCO3+H2SO4=FeSO4+CO2↑+H2O
116 98
11.6g x
116:98=11.6g:x
x=9.8g
所用稀硫酸的溶質質量分數=9.8g/50g×100%=19.6%


 每課必練系列答案
每課必練系列答案科目:初中化學 來源: 題型:
【題目】甲和乙在一定條件下反應生成丙和丁。結合微觀示意圖分析,下列結論正確的是
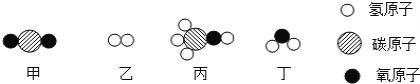
A.該反應是置換反應 B.反應前后各元素的化合價不發生變化
C.反應前后分子總數不變 D.發生反應的甲和乙的質量比為 22∶3
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】(4分)2015年4月6日,福建漳州古雷騰龍芳烴PX項目聯合裝置區發生爆炸,造成嚴重污染,PX 是對二甲苯(p-xylene)的簡寫,其結構式如圖,分子式為C6H4(CH3)2,它是一種透明液體,不溶于水,具有芳香氣味,有毒,蒸汽可以和水蒸氣混合形成爆炸性混合物,請根據所學回答如下問題:
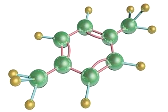
(1)對二甲苯屬于 。(填“無機物” 或“有機物”)。
(2)對二甲苯中氫元素的質量分數是 (準確至0.1%),
(3)碳、氫原子個數之比是 (最簡比)
(4) g對二甲苯與3.2g甲烷含等質量的碳元素。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】(4分)化學就在我們身邊,它能改善我們的生活。請從“A~氧氣;B~食鹽;C~生石灰;D~明礬”中選擇適當的物質填空(填寫相應的字母)。
(1)搶救危重病人常用的物質是 ;
(2)廚房中的食品調味劑是 ;
(3)常用作袋裝食品干燥劑的是 ;
(4)凈化水時可作絮凝劑的是 。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】對照實驗是研究物質性質的一種重要方法。下列不能達到實驗目的的是

A.比較紅磷、白磷的著火點
B.探究MnO2能加快過氧化氫分解的速率
C.探究分子運動以及分子運動的速度與相對分子質量大小的關系
D.比較Na2CO3、NaHCO3的熱穩定性的大小
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】甲烷和水反應也可以制水煤氣,其反應的微觀示意圖如下所示:

下列對該反應的敘述正確的是
A.反應前后分子個數不變
B.生成物丙中各元素的質量比為1∶1
C.生成的丙和丁的分子個數比為1∶1
D.若有24g的甲參加反應,則生成丁的質量為9g
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】(8分)電石是一種重要的化工原料,極易與水反應:CaC2+2H2O=Ca(OH)2+X↑。
(1)將電石長期露置于空氣中,會發生下列變化:
![]()
題干中電石與水反應后所得的氣體X的化學式是_______,殘渣中的主要成分是Ca(OH)2和_______ (寫名稱)。
(2)工業上利用電石制備某化工原料的流程如下(注:加入NH4Cl溶液的目的是溶解殘渣中的難溶鹽):
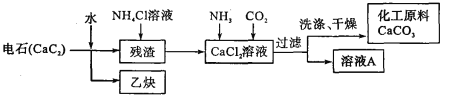
①CaCl2溶液中通人NH3、CO2兩種氣體,生成CaCO3的化學方程式為_______ 。
②流程中溶液A可循環使用,溶液A中的主要成分的化學式是_______。
③實驗室中對過濾所得的固體進行洗滌在_______ 中進行,加洗滌劑時以浸沒固體的量為宜。
(3)檢驗沉淀洗滌干凈的方法:取最后一次洗滌液少量置于試管中滴加試劑硝酸銀溶液,若觀察到_______ ,則證明洗滌干凈。
(4)電石應該_______保存。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下圖是甲、乙兩種固體物質在水中的溶解度曲線。下列說法不正確的是
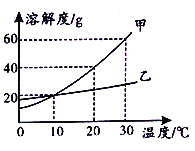
A.10 ℃ 時,甲、乙兩種物質的飽和溶液濃度相同
B.保持20 ℃ ,蒸發溶劑可使接近飽和的乙溶液變成飽和溶液
C.30 ℃ 時,將40g 甲物質加人50g水中,充分溶解后溶液的質量為80g
D.10 ℃ 時,將兩種飽和溶液升溫至30 ℃ ,溶液中溶質的質量分數都增大
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】(10分)某研究性學習小組利用下圖裝置探究溫度對CO還原Fe2O3的影響(固定裝置略)。
查閱資料:CO2 + Zn ![]() CO + ZnO;FeCl3溶液遇KSCN溶液變紅。
CO + ZnO;FeCl3溶液遇KSCN溶液變紅。

請回答下列問題:
(1)儀器A的名稱是 ,裝置B的作用是 ,尾氣處理的方法是 。
(2)將研究小組分為兩組,按上圖裝置進行對比實驗,甲組用酒精燈、乙組用酒精噴燈對裝置D進行加熱,其產物均為黑色粉末(純凈物)。兩組分別用產物進行以下實驗:
步驟 | 操作 | 甲組現象 | 乙組現象 |
1 | 取黑色粉末加入鹽酸 | 溶解,無氣泡,溶液呈淺黃綠色(含兩種金屬離子) | 溶解,有氣泡,溶液呈淺綠色 |
2 | 取步驟1所得溶液,滴加KSCN溶液 | 變紅 | 無現象 |
則甲組步驟1中反應的化學方程式是 ,乙組得到的黑色粉末是 。
(3)從安全考慮,本實驗應在裝置 和 之間添加裝置E防止倒吸。(填字母編號)
(4)該對比實驗結果表明CO的還原能力隨溫度的升高而 (填“增強”或“減弱”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com