
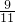 ═414m3 ;
═414m3 ;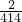 =
=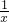 x=207m3 ;
x=207m3 ;


| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:初中化學(xué) 來(lái)源: 題型:
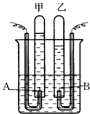 阿伏加德羅曾經(jīng)總結(jié)出一條定律:在同溫、同壓下,同體積的任何氣體都含有相同的分子數(shù).如圖是簡(jiǎn)易電解水的裝置圖,試根據(jù)觀察到的實(shí)驗(yàn)現(xiàn)象回答下列問(wèn)題:
阿伏加德羅曾經(jīng)總結(jié)出一條定律:在同溫、同壓下,同體積的任何氣體都含有相同的分子數(shù).如圖是簡(jiǎn)易電解水的裝置圖,試根據(jù)觀察到的實(shí)驗(yàn)現(xiàn)象回答下列問(wèn)題:查看答案和解析>>
科目:初中化學(xué) 來(lái)源: 題型:
查看答案和解析>>
科目:初中化學(xué) 來(lái)源:不詳 題型:問(wèn)答題
查看答案和解析>>
科目:初中化學(xué) 來(lái)源:2004年第十四屆“天原杯”全國(guó)初中學(xué)生化學(xué)素質(zhì)和實(shí)驗(yàn)?zāi)芰Ω?jìng)賽(北京賽區(qū))初賽試卷(解析版) 題型:解答題
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com