學習了教材中O
2的制法后,某小組同學查找資料知道,加熱5%的H
2O
2溶液,也能夠制得O
2,其反應的化學方程式為:2H
2O
2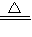
2H
2O+O
2↑
小組同學將5%的H
2O
2溶液放在試管中加熱,用帶火星的木條在試管口檢驗產生的O
2 時,發現帶火星的木條很難復燃.
【猜想與假設】:
①產物中有水蒸氣,帶火星的木條不能復燃.
②產生的O
2量少,帶火星的木條不能復燃.
【設計改進方案】:
針對猜想①,甲同學設計了如右圖所示的裝置,B瓶中應盛放的干燥劑應是
.
針對猜想②,乙同學使用10%的H
2O
2溶液進行上述實驗;丙同學向5%的H
2O
2溶液中加入2滴新制的NaOH溶液,加熱一段時間.
三位同學用帶火星的木條檢驗,均復燃.
【反思與評價】:
①甲同學設計的裝置有一處不盡合理,請你做以下改進
.
②由乙同學的實驗可得出,影響H
2O
2溶液產生O
2量的多少的因素可能是
.
③丙同學分析得出NaOH溶液所起的作用可能是
.
【拓展與交流】:
①資料表明:在常溫下固體MnO
2與5%H
2O
2溶液混合同樣能夠制得O
2,你會選擇與實驗室制取
(填“O
2”或“CO
2”)相似的發生裝置進行實驗.
②與KMnO
4制取O
2比較,用5%H
2O
2溶液與MnO
2混合制得O
2有其優越性,如
,(答出-點即可).


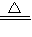 2H2O+O2↑
2H2O+O2↑


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案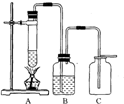 學習了教材中O2的制法后,某小組同學查找資料知道,加熱5%的H2O2溶液,也能夠制得O2,其反應的化學方程式為:2H2O2
學習了教材中O2的制法后,某小組同學查找資料知道,加熱5%的H2O2溶液,也能夠制得O2,其反應的化學方程式為:2H2O2