
【題目】金屬是一種非常重要的資源,在生產、生活中有著廣泛的用途.
(1)人類每年從自然界提取大量的金屬,其中提取量最大的是鐵.用赤鐵礦和一氧化碳煉鐵的化學方程式為_____.
(2)央視315晚會曝光某品牌汽車廠為了節約成本,采用價格相對便宜的普通鋼板代替防腐性能較好的鍍鋅板,造成鋼板生銹,給車主帶來極大安全隱患.普通鋼板在空氣中銹蝕,實際上是鐵跟空氣中的_____共同作用的結果.
(3)請寫出工業上用稀硫酸除鐵銹的化學反應方程式_____.
(4)亮亮同學用稀鹽酸和另一種溶液,驗證了Mg、Fe、Cu、Ag四種金屬的活動性順序是依次減弱的.請問亮亮所用的另一種溶液是_____.
【答案】Fe2O3+3CO![]() 2Fe+3CO2 氧氣和水 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 硝酸銀溶液
2Fe+3CO2 氧氣和水 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 硝酸銀溶液
【解析】
(1)赤鐵礦煉鐵是工業上利用一氧化碳進行還原制取。
(2)鐵生銹的條件是與氧氣和水接觸。
(3)考慮鐵銹的主要成分是氧化鐵,氧化鐵和稀硫酸反應生成硫酸鐵和水。
(4)根據金屬活動性順序表及其應用分析,氫前的金屬能與酸反應生成氫氣,位置在前的金屬能將位于其后的金屬從其鹽溶液中置換出來。
(1)一氧化碳具有還原性,能把鐵從它的氧化物中還原出來,該反應是: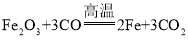 ,故填:
,故填: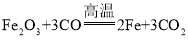 。
。
(2)普通鋼板在空氣中銹蝕,實際上是鐵跟空氣中的氧氣和水共同作用的結果,故填:氧氣和水。
(3)稀硫酸去除鐵銹的化學反應方程式為:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,故填:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
(4)由金屬活動性順序表及其應用可知,運用稀鹽酸首先可驗證鎂比鐵活潑,鎂、鐵比銅、銀活潑.因為稀鹽酸和鐵鎂能反應生成氫氣,而銅銀與稀鹽酸不反應不產生氫氣,且鎂比鐵產生氫氣的速度快.但不能驗證銅和銀的金屬活動性.利用金屬活動順序表中前面的金屬能把后面的金屬從它的化合物的溶液中置換出來,可用硝酸銀溶液來比較銅銀的活動性,故填:硝酸銀溶液。


 每日10分鐘口算心算速算天天練系列答案
每日10分鐘口算心算速算天天練系列答案科目:初中化學 來源: 題型:
【題目】已知A~F是初中化學常見的幾種物質,它們之間存在下圖所示的反應關系(圖中“一”表示兩端的物質在一定條件下能反應,“→” 表示轉化關系,且圖中反應均為初中常見的反應),其中A、D、E、F是四種不同類別的物質,A是常用于改良酸性土壤的堿,A、B、C含有相同的金屬元素,D的溶液顯藍色,E與F反應得到淺綠色溶液,F由兩種元素組成。請回答下列問題:
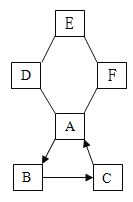
(1)寫出E的化學式________。
(2)F的一種用途_______。
(3)用化學方程式表示A→B的反應______。
(4)圖中的反應與轉化中涉及四種基本反應類型中的______種。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】一凡同學對生鐵的組成進行研究,稱取生鐵樣品 40g,把 500g 稀硫酸分 5 次加入樣品中, 測得實驗數據見下表:(雜質不溶于水,也不和稀硫酸反應)
實驗序號 | 加入稀硫酸的質量/g | 剩余固體的質量/g |
第 1 次 | 100 | 28.8 |
第 2 次 | 100 | 17.6 |
第 3 次 | 100 | M |
第 4 次 | 100 | 1.2 |
第 5 次 | 100 | N |
(1)第 3 次剩余固體的質量 M=_____第 5 次剩余固體的質量 N=_____
(2)該生鐵樣品中鐵的質量分數為_____。
(3)計算第 3 次反應結束后所得溶液的溶質質量分數。_____(寫出計算過程,保留一位小數)
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】(1)用化學用語填空
①4個氨分子_____;
②3個氫氧根離子_____;
③水銀_____;
④氦氣_____;
⑤KIO3中碘元素的化合價_____。
(2)寫出三大化石燃料中,較清潔燃料燃燒的化學方程式_____。
(3)元素周期表中原子序數為 1、8、20 的元素組成物質的化學式為_____。
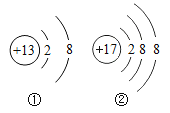
(4)如圖①②中屬陽離子的是_____( 填離子符號),該元素的質子數為_____;17 號元素位于元素周期表第_____周期。
(5)已知 R、M 兩種元素離子 R+和 M2-核外電子數相同,且R的核電荷數為 11,則 M原子的質子數為_____。
(6)二氧化碳和氫氣在一定條件下轉化為化工原料乙烯(C2H4),是我國科學研究的又一重大突破,其反應化學方程式為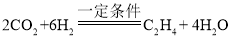
其反應微觀過程可以表示為:
請將下圖對應序號填入上述反應微觀過程的對應框圖內_____。
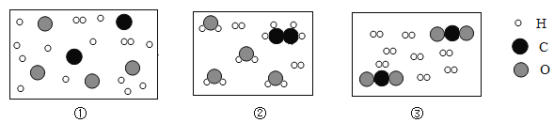
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】通過一年的化學學習,相信你已經初步掌握了實驗室制取氣體的有關知識。請結合圖示回答問題:

(1)儀器a的名稱是_____;
(2)甲同學欲用高錳酸鉀制取并收集較純的氧氣,應選擇的裝置組合是_____(填字母),用該方法制取氧氣的化學方程式為_____;該同學用排水法收集氧氣,實驗結束后,他發現水槽中的水變紅了,請你幫他分析可能的原因:_____;
(3)裝置A和裝置C都可以用于制取同種氣體,裝置C的優點是_____;
(4)某同學用裝置E收集氣體,則該氣體應滿足的條件是_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】向一定量的NaOH溶液中慢慢通入CO2氣體,看不到明顯現象。某實驗小組的同學對所得溶液成分進行了如下探究。請你參與他們的探究活動,并完成以下問題:
(提出問題)所得溶液中溶質的成分是什么?
(査閱資料)資料一:將CO2氣體慢慢地通入一定量的NaOH溶液中,可能發生以下兩個化學反應:
先發生反應:2NaOH+CO2═Na2CO3+H2O
當NaOH反應完全后,繼續發生反應:Na2CO3+CO2+H2O═2NaHCO3
資料二;Ca(HCO3)2易溶于水;CaCl2溶液與NaCl溶液均呈中性; NaHCO3溶液呈堿性,可使酚酞溶液變紅色。
(猜想與假設)小組同學通過討論,提出了以下四種猜想
猜想一:溶質為NaOH和Na2CO3
猜想二:溶質全為Na2CO3
(1)你認為猜想三:溶質為_____
猜想四:溶質全為 NaHCO3
(實驗探究)小組同學設計并完成了如下實驗:
實驗步驟 | 實驗過程 | 實驗現象 | 實驗結論 |
① | 取適量反應后的溶液置于試管 中,加入過量CaCl2溶液 | 有白色沉淀生成 | (2)猜想_____不成立 |
② | 取適量步驟①反應后的上層清 液,滴加幾滴酚酞溶液 | (3)現象為_____ | 猜想二不成立 |
③ | 取適量步驟①反應后的上層清 液,加入適量稀HCl | 有氣泡產生 | (4)猜想_____成立 |
(實驗總結)針對上述實驗,實驗小組的同學總結并寫出了上述探究過程中的各步反應方程式。
(5)你認為步驟①發生反應的化學方程式是_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】酸、堿、鹽在生產和生活中有廣泛的應用。
(1)焙制糕點所用發酵粉中含有碳酸氫鈉,其俗名為______(填字母代號)。
a純堿
b燒堿
c蘇打
d小蘇打
(2)如圖1是氫氧化鈉溶液與硫酸反應時溶液pH變化的示意圖。
①根據圖示判斷,該實驗是將______(填“氫氧化鈉溶液”或“硫酸”)滴加到另一種溶液中。
②滴入溶液體積為V2mL時,溶液中的溶質為_______。
(3)為除去粗鹽水中的可溶性雜質MgSO4、CaCl2,某化學小組設計了如圖2方案:
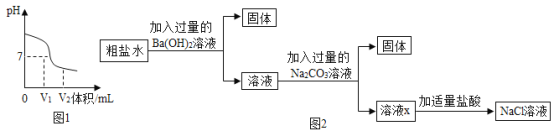
①過濾用到的玻璃儀器有燒杯、玻璃棒和______。
②寫出加入Ba (OH) 2溶液時反應的化學方程式____。(提示:微溶物不形成沉淀)
③溶液X中含有哪些雜質?______。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】甜葉菊苷具有高甜度低熱能的特點,是一種新型甜味劑,我國是全球最主要的生產國,實驗小組欲探究甜葉菊苷的元素組成,進行如下實驗:
[提出猜想] 甜葉菊苷由什么元素組成?
[進行實驗]小晴取適量的甜葉菊苷按圖進行操作,并分別將干冷的燒杯和蘸有澄清石灰水的燒杯倒置與火焰上方。
[討論交流]其他同學認為小晴的實驗設計不嚴謹,原因是____________________________。經改進試驗后,檢驗到甜葉菊苷在氧氣中充分燃燒的產物只有二氧化碳和水,由此確定甜葉菊苷中一定含有碳,氫元素。
[繼續探究]為了進步確定其元素組成。利用下圖進行實驗。(已知:裝置中C中的氧化銅能確保甜葉菊苷中的碳元素完全轉化為二氧化碳)
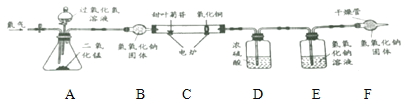
(1)實驗前要通一會兒氮氣,目的是_________________。
(2)A裝置中發生反應的化學方程式為__________________________。
[數據記錄]4.02g甜葉菊苷在C裝置中充分燃燒后,D裝置增重2.7g, E裝置增重8.36g。(產物被完全吸收)
[分析與結論]數據分析: 4.02g 甜葉菊苷中氧元素的質量為___g,由此可以確定甜葉菊苷是由碳,氫,氧元素組成。
[反思評價]若沒有F裝置,對氧元素質量測定結果的影響是_____________。 (填“偏大”、“偏小”或“無影響”)。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】研究物質的溶解度對于生產、生活有著重要意義。經實驗測定,獲得不同溫度時硝酸鉀的溶解度數據。分析下列表格中的數據,某溫度時的硝酸鉀溶解度數據可能存在較大的誤差,該溫度是_____℃。
溫度(℃) | 20 | 40 | 50 | 60 | 70 | 80 |
溶解度(g/100g 水) | 31.6 | 63.9 | 145 | 110 | 140 | 169 |
請根據表中的數據,在坐標圖中描點、繪制符合硝酸鉀溶解度變化規律的曲線。_____
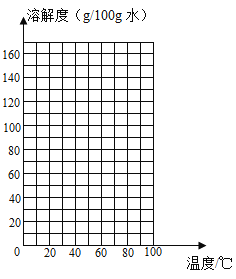
可知:硝酸鉀的溶解度隨溫度升高而_____(選填 “增大”或“減小”); 60℃時,將60g硝酸鉀固體加入50g水中,所形成的溶液為_____溶液(填寫“飽和”或“不飽和”),所得溶液的溶質質量分數為_____ (精確到0.1%)。下圖是有關硝酸鉀溶液的實驗操作及變化情況,已知溶液①到溶液②的過程中,溶液質量保持不變,
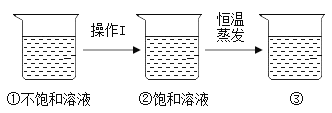
操作I的具體名稱為_____,三種溶液的溶質質量分數大小關系為①_____②_____③(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com