
分析 為了探究金屬Mg、Zn、Fe與酸反應的快慢,需要控制酸、金屬及操作等可變量,酸應使用質量分數相同、質量相同的同一種酸,金屬應取大小相同、外觀一致的金屬,操作時應同時加入、相同的氣球也應同時套在試管口上.
解答 解:(1)鎂與鹽酸反應,生成氯化鎂和氫氣;
故答:Mg+2HCl=MgCl2+H2↑;
(2)三種金屬中,鎂的活動性最強,放出氫氣速率最大,所以放入鎂的A試管氣球膨脹速度最快;
故選A;
(3)實驗室制取氣體時要求反應速度不能太快,反應太劇烈不宜于控制;也不能反應速度太慢,太慢收集需要太長時間;鎂與酸反應太快、鐵反應速度太慢,實驗室制取氫氣時不選用這兩種金屬;
故答:鋅反應速度適中,容易控制(或鎂反應速度太快,而反應速度太慢,或Mg>Zn>Fe);
(4)本次探究是通過觀察氣球膨脹速度來判斷反應快慢的,所以,加入金屬、在試管口套氣球等都要同時完成,否則氫氣逸散使實驗結果出現較大誤差;
故答:迅速并同時完成加入金屬和套上氣球的操作.
答案:
(1)Mg+2HCl=MgCl2+H2↑;
(2)A;
(3)鋅反應速度適中,容易控制(或鎂反應速度太快,而反應速度太慢,或Mg>Zn>Fe);
(4)迅速并同時完成加入金屬和套上氣球的操作.
點評 實驗室制取氫氣通常選擇鋅粒與稀硫酸反應,一般選擇稀硫酸而不選擇稀鹽酸是由于稀硫酸沒有揮發性而鹽酸有揮發性.


 名校課堂系列答案
名校課堂系列答案科目:初中化學 來源: 題型:推斷題
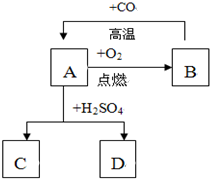 已知A、B、C、D、E是初中化學常見的物質.D物質的水溶液為淺綠色,C是密度最小的氣體,它們的轉化關系如圖所示:
已知A、B、C、D、E是初中化學常見的物質.D物質的水溶液為淺綠色,C是密度最小的氣體,它們的轉化關系如圖所示:查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
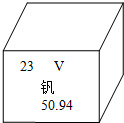 我市盛產金屬銻.右下圖是釩元素在元素周期表中的部分信息,下列有關說法正確的是( )
我市盛產金屬銻.右下圖是釩元素在元素周期表中的部分信息,下列有關說法正確的是( )| A. | 釩元素屬于非金屬元素 | B. | 釩元素的相對原子質量是50.94g | ||
| C. | 釩原子有23個中子 | D. | 釩元素的原子序數為23 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | CuSO4和NaOH | B. | NaOH和HCl | C. | AgNO3 和HCl | D. | Ca(OH)2 和Na2CO3 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
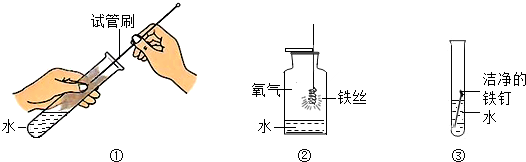
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com