
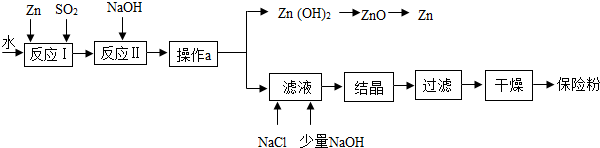
分析 (1)Zn+2SO2═ZnS2O4,該反應的反應物是兩種,生成物是一種,進行分析解答.
(2)反應Ⅱ為復分解反應,則ZnS2O4與氫氧化鈉溶液交換成分反應生成氫氧化鋅沉淀和Na2S2O4,進行分析解答.
(3)操作a是將氫氧化鋅沉淀與濾液分離,進行分析解答.
(4)根據題意,濾液中含有Na2S2O4,Na2S2O4在堿性溶液中穩定,在中性和堿性溶液中極不穩定;在NaCl存在下,Na2S2O4在水中溶解度顯著下降,進行分析解答.
(5)由質量守恒定律,反應前后鋅元素的質量不變,進行分析解答.
解答 解:(1)Zn+2SO2═ZnS2O4,該反應的反應物是兩種,生成物是一種,屬于化合反應.
(2)反應Ⅱ為復分解反應,則ZnS2O4與氫氧化鈉溶液交換成分反應生成氫氧化鋅沉淀和Na2S2O4,該反應的化學方程式為ZnS2O4+2NaOH═Zn(OH)2↓+Na2S2O4.
(3)操作a是將氫氧化鋅沉淀與濾液分離,操作a的名稱為過濾.
(4)濾液中含有Na2S2O4,Na2S2O4在堿性溶液中穩定,在中性和堿性溶液中極不穩定,則為使Na2S2O4結晶析出還需要加入少量NaOH的原因是可調節溶液為堿性,使 Na2S2O4結晶穩定存在.
在NaCl存在下,Na2S2O4在水中溶解度顯著下降,加入NaCl的原因是氯化鈉的存在使Na2S2O4的溶解度降低,更易結晶析出,提高產率.
(5)由質量守恒定律,反應前后鋅元素的質量不變,198gZn(OH)2理論上能得到Zn的質量為198g×$\frac{65}{65+(16+1)×2}×$100%=130g.
故答案為:(1)化合反應;(2)ZnS2O4+2NaOH═Zn(OH)2↓+Na2S2O4;(3)過濾;(4)可調節溶液為堿性,使 Na2S2O4結晶穩定存在;氯化鈉的存在使Na2S2O4的溶解度降低,更易結晶析出,提高產率;(5)130g.
點評 本題有一定難度,理解Na2S2O4的制備流程如圖,熟練掌握化合反應與復分解反應的特征、過量的原理、化學式的有關計算等是正確解答本題的關鍵.


 學練快車道口算心算速算天天練系列答案
學練快車道口算心算速算天天練系列答案科目:初中化學 來源: 題型:實驗探究題
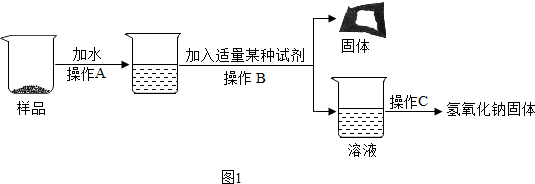
查看答案和解析>>
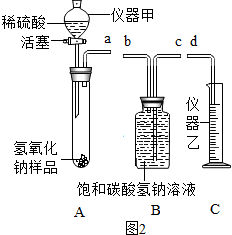
科目:初中化學 來源: 題型:推斷題
 .
.
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | H2 | B. | O2 | C. | H2O2 | D. | H2SbO4 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| 選項 | 物質(括號內為雜質) | 除雜試劑 | 實驗操作 |
| A | MnO2(KC1O3) | 水 | 溶解、過濾 |
| B | CO2(CO) | O2 | 點燃 |
| C | KCl(KOH) | 稀H2SO4 | 蒸發結晶 |
| D | 鐵粉(碳粉) | 稀HC1 | 過濾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | NaCl 氯化鈉 食鹽 | B. | CaO 氧化鈣 熟石灰 | ||
| C. | Na2CO3 碳酸鈉 純堿 | D. | NaOH 氫氧化鈉 燒堿 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| 液體 | 胃液 | 胰液 | 膽汁 | 血漿 |
| pH | 0.9-1.5 | 7.5-8.0 | 7.1-7.3 | 7.35-7.45 |
| A. | 胃液 | B. | 胰液 | C. | 膽汁 | D. | 血漿 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題

查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com